![澳门威斯人游戏平台[亚洲]全站最新版V11.37.7](/wp-content/themes/2023/images/banner/technical-resources.jpg?v=18)
天然IgM抗体与NK细胞、DC细胞、肥大细胞以及巨噬细胞是先天免疫系统的一部分,是抵御入侵微生物和异常人类细胞的第一道防线。这种免疫反应涉及与特定的抗原基序结合,例如糖蛋白或糖脂上的特定糖类或类似脂多糖的重复结构,由胚系(即未突变)基因编码的IgM抗体识别。通常,这些天然IgM抗体与一系列相似的外来抗原的亲和力不高,然而通过与这些外来抗原之间10个(在五聚体中)或12个(在六聚体中)位点的结合,其间的亲合力(avidity)被扩增。IgM抗体在锚定补体、调理吞噬作用的强效能力使其对细菌和病毒的防御特别有效。
IgM抗体与IgG的效应机制也有所不同。IgG利用NK细胞的参与,产生抗体依赖性细胞介导的细胞毒性(ADCC)以及补体依赖性细胞毒性(CDC)。IgM不结合Fcγ受体,因此不表现出ADCC。然而IgM具有非常强的CDC活性,它们的六聚体或五聚体结构允许其与补体C1q高度亲和结合,因此IgM能够比IgG更好地锚定补体。Sharp等人最近使用相板冷冻电子显微镜进行的工作提供了一个详细的模型,说明了抗原结合时是如何发生构象变化从而启动补体锚定的,同时也更清晰地了解到IgM与C1q结合的区域,即启动补体级联所需的第一个蛋白复合物。当Fab区在细胞表面上结合抗原时,游离IgM的平面或盘状结构变为“蹲伏”或“吻合样”结构。由于Cμ2区域的柔韧性,抗原结合Fab区从Cμ3,Cμ4和尾部肽成的环平面中移出。这允许许多或所有Fab臂接触表面抗原,从而利用IgM的亲合力。其他效应机制,如抗体依赖性细胞吞噬作用,也与IgM的作用有关。
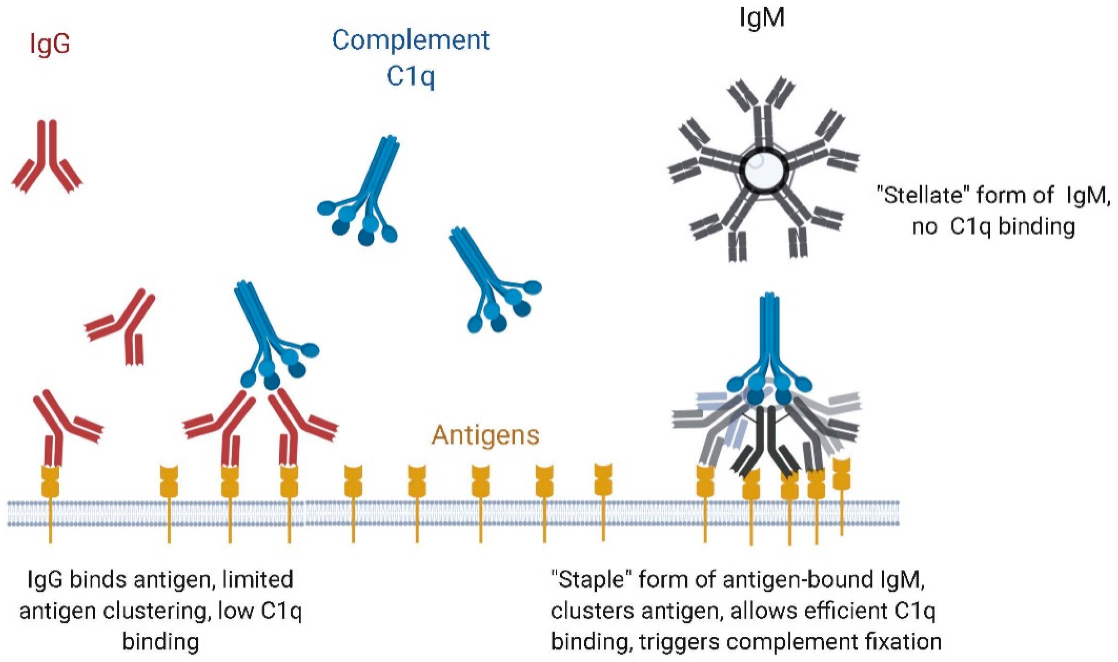
图1 IgG与IgM结合和激活补体示意图
已知IgM抗体与多个受体结合,下面主要讨论这三种受体的功能作用。
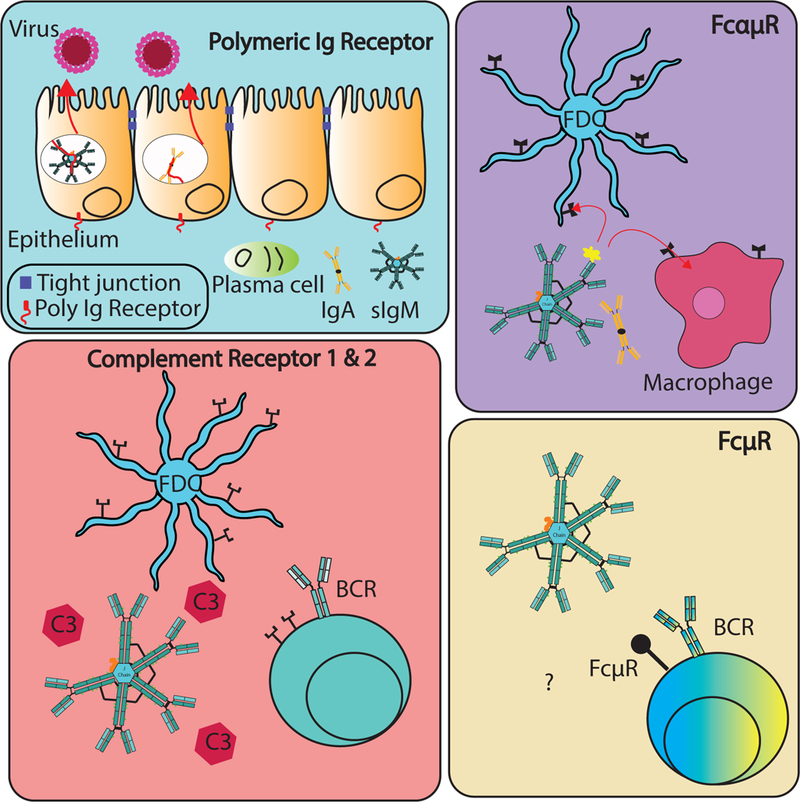
图2 已知结合IgM的受体的示意图
1. 多聚免疫球蛋白受体(pIgR)
pIgR是一种单跨膜膜蛋白,其结构可分为胞外结构域、跨膜结构域和胞内结构域,其N端在细胞外C端在细胞内。整个蛋白由约620个氨基酸构成的胞外结构域、23个氨基酸构成的跨膜结构域和103个氨基酸构成的胞内结构域组成。pIgR具有五个Ig样结构域(D1-D5),这些结构域糖基化水平高。铰链区存在于D1和D2之间以及D3和D4之间。
pIgR与含有J链的聚合IgM或IgA抗体结合后,可被内化并由核内体从基底表面运输至顶端表面。上皮细胞黏膜表面端区域包含一个蛋白水解敏感位点,当核内体移动到顶端时,在该位点发生水解,这导致与pIgR胞外域结合的聚合Ig释放。pIgR未与配体结合的情况下,运输至上皮细胞黏膜表面端时也会被蛋白酶水解,在顶端作为8 kDa片段释放。这种被分裂后释放的部分称作分泌成分(secretory component,SC)。含有J链的聚合免疫球蛋白(如IgA和IgM)通常与分泌成分一起存在于黏膜表面。
pIgR在黏膜上皮的基底层表达,在小肠和大肠中表达最高,在肺、胰腺、肾脏和子宫内膜等组织中也可见表达。
2. Fcα/μR
在筛选能够结合IgM的小鼠淋巴瘤细胞系受体的过程中,人们发现了Fcα/μ受体。该受体大小约为70 kDa,属于免疫球蛋白超家族,并且被广泛糖基化。Fcα/μ受体的主要在巨噬细胞和生发中心的滤泡树突状细胞表达,分别以中等和高度亲和力与IgM和IgA结合,介导IgM/IgA抗原复合物的内吞作用。表达Fcα/μ受体与pIgR一样,Fcα/μ受体主要通过与Cμ3和Cμ4中的决定簇与IgM相互作用。
Fcα/μ受体分布在淋巴组织,包括淋巴结和阑尾中,在包括肾脏和肠道在内的非淋巴组织中也广泛表达,在肺、肝和心肌中观察到较低的表达。Fcα/μ受体在肠道巨噬细胞、浆细胞和潘氏细胞上的表达暗示了其在黏膜免疫的局部和全身作用。
3. FcμR(FAIM3/TOSO受体)
最新发现的与IgM相互作用的受体是FcμR,它是一种约60 kDa的跨膜唾液酸蛋白。FcμR也称为TOSO受体,在慢性淋巴细胞白血病B细胞上高度表达,并且已被证实在IgM结合时内化。它与pIgR和Fcα/μ的不同之处在于它只与IgM结合而不与IgA结合。
识别IgM的FcμR的CDR1区域可能非常短,只有五个氨基酸。值得注意的是,FcμR不需要J链来结合IgM,其相互作用区域主要被认为是与Cμ3和Cμ4。
在人类和小鼠中,FcμR在B细胞上的表达最强,此外在小鼠的粒细胞、巨噬细胞和树突状细胞上也观察到低表达。在人体内,该受体在T细胞和NK细胞上表达,但在骨髓细胞上没有表达。
FcμR在稳态中具有多种功能:在发育中维持适当的IgM-BCR表达水平,防止自反应性B细胞(特别是B-1)的过度激活,并防止自身免疫抗体介导疾病的发展。在外来抗原暴露后,根据抗原剂量,FcμR可以通过与B细胞结合直接改变B细胞反应的强度,至少在人类中,也可以通过增强T细胞反应间接改变。事实上,FcμR表达的增强和抑制作用已在T非依赖性和T依赖性抗原的体液反应中被发现,这表明抗原类型、剂量和细胞亚群特异性等其他调节机制的可能性。然而,FcμR−/−小鼠表面IgM-BCR表达的失调仍有待充分考虑其潜在影响,它可能有助于理解在没有FcμR的情况下对免疫反应发展的影响。
参考文献
[1]Keyt BA, Baliga R, Sinclair AM, et al. Structure, Function, and Therapeutic Use of IgM Antibodies. Antibodies[J], 2020, 9(4): 53. doi:10.3390/antib9040053
[2]Blandino R, Baumgarth N. Secreted IgM: New tricks for an old molecule. J Leukoc Biol[J], 106(5):1021-1034. doi: 10.1002/JLB.3RI0519-161R
[3]Liu J, Wang Y, Xiong E, et al. Role of the IgM Fc Receptor in Immunity and Tolerance. Front Immunol. 2019 Mar 22;10:529. doi: 10.3389/fimmu.2019.00529

澳门威斯人游戏平台[亚洲]全站最新版V11.37.7 Nanjing Detai Bioengineering Co.,Ltd. ©2024 All Rights Reserved
苏ICP备2021019379号-1 | 网站地图 | 用户协议 | 隐私政策