![澳门威斯人游戏平台[亚洲]全站最新版V11.37.7](/wp-content/themes/2023/images/banner/technical-resources.jpg?v=18)
免疫球蛋白Y(IgY)是一种广泛存在于鸟类、爬行动物、两栖动物和肺鱼中抗体同种型,它在结构和功能上与哺乳动物的IgG和IgE同源,被认为是IgG和IgE的进化前体。禽类IgY在功能上与哺乳动物IgG相似,曾被提议应命名为“禽类IgG”。(本文禽类IgY抗体均特指鸡IgY)。
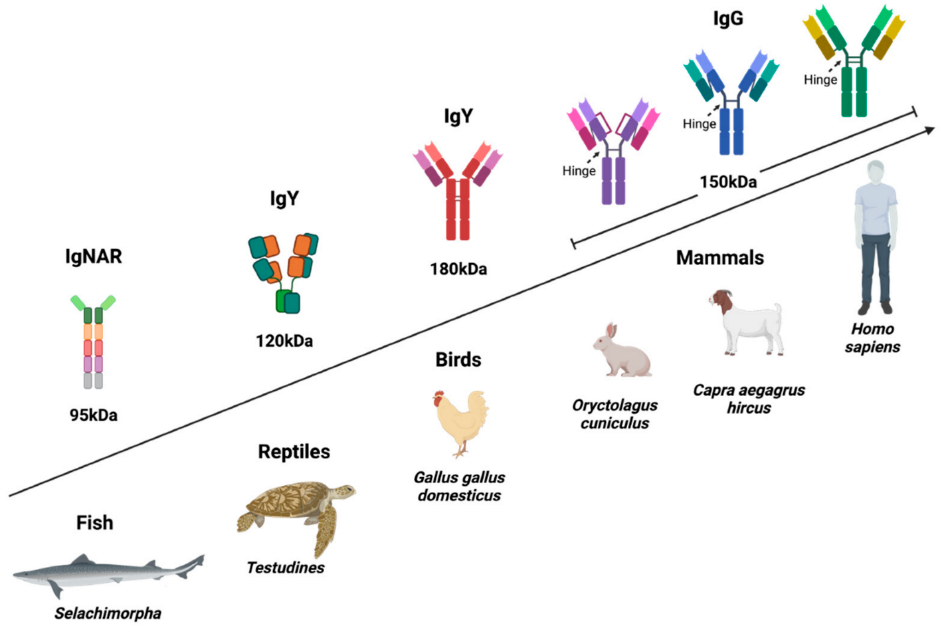
图1 IgY与不同物种的IgG的结构比较
免疫球蛋白呈对称的Y型结构,通常由两条相同的重链和两条相同的轻链组成。哺乳动物IgG重链恒定区由CH1、CH2和CH3组成,其中CH2和CH3构成Fc区。轻链只有一个恒定区,用CL表示。可变区片段Fv由重链可变区(VH)和轻链可变区(VL)组成。VH和VL分别与CH1和CL相连,共同组成Fab区。重链和轻链之间通过CH1和CL所含半胱氨酸形成的二硫键相连,Fab和Fc通过位于重链的CH1和CH2之间的铰链区相连,两条重链通过铰链区内的二硫键相连,最终形成一个约150 kDa的抗体分子。
哺乳动物IgG和禽类IgY在结构上的差异主要体现在恒定区。IgY的CH1和CH2之间缺乏铰链区,这限制了IgY的柔韧性,铰链区中连接两条重链的二硫键也相应缺失。IgY连接两条重链的二硫键位于CH2,该区域存在四个典型的半胱氨酸,其中两个形成重链链间二硫键,其余两个形成链内二硫键。除此之外,IgY存在额外的CH4域。因此IgY的分子量(180 kDa)略高于IgG。
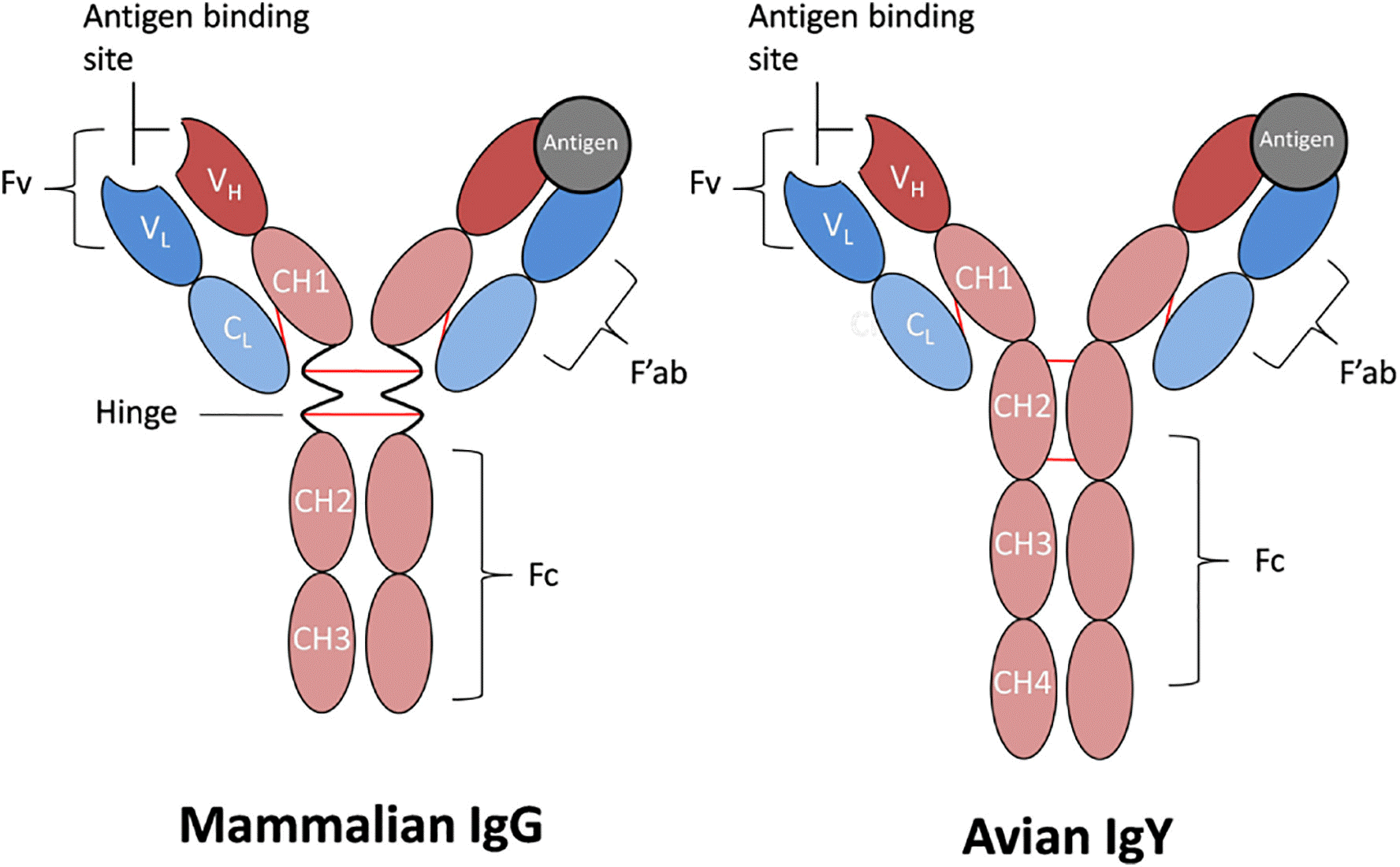
图2 IgG和IgY的典型结构
通过对未免疫处理鸡抗体库VH序列的分析发现,与IgG相比,IgY VH CDR3残基数较多;此外,IgY VH CDR3含有非规范内的半胱氨酸残基,这些残基可形成链内二硫键,赋予结构额外的稳定性,这一特征在IgG VH CDR3中不明显。

图3 鸡、小鼠、人的CDR3长度分布比较
红色:未免疫鸡VH CDR3长度分布
灰色:小鼠VH CDR3长度分布
黑色:人类VH CDR3长度分布
至于VL链,禽类只表达λ轻链,而哺乳动物主要表达κ轻链。IgY VLλ与哺乳动物IgG VLλ在序列和结构上具有显著的同源性。一个显著的区别是,IgY VLλ CDR1的标准结构要比IgG的明显要短。这种差异在分析种系和免疫处理后鸡的VLλ CDR时也被观察到了,因此推测这与抗原驱动因素无关。这可能出于进化压力,这样IgY较短的VL CDR1可以与较长的VH CDR3之间做到结构互补。
禽类免疫球蛋白种系基因包括VL基因位点上的V基因片段和J基因片段,以及VH基因位点上额外的D基因片段。与人类、小鼠VH基因家族和VL基因家族中存在多个种系不同,禽类VH和VL基因家族只存在一个功能性的基因片段。因此禽类抗体中虽然存在V-D-J和V-J重排,但重排过程对抗体序列多样性的贡献很小。禽类抗体的多样性主要是通过V-D-J和V-J重排后的基因转换和体细胞超突变机制产生的。
基因转换是指供体基因片段单向转移到同源受体基因片段,导致供体序列在该区域复制的过程。受体片段可发生多次转换事件,这是禽类IgV基因库多样性产生的重要机制。位于5’端上游的80~100个重链假基因(ψVH)和25个轻链假基因(ψVL)与重排的VH和VL基因片段具有同源性,可以为V区受体提供供体序列。大多数基因转换事件发生在VH的D基因片段,这是CDR3多样性的保证。而VL基因转换仅发生于VL区而不延续到JL区。基因转换过程会在个体VH和VL库中产生大量的排列,再加上重轻链的配对,可以产生约3×109种组合的抗体库。
产生多样性的另一种机制称为体细胞超突变。体细胞突变在分裂细胞中发生的频率较低,但它在B细胞中发生频率较高(单个细胞分裂过程中,每103个核苷酸对中就有一个突变发生)。这种比其他细胞高一百万倍的点突变率仅出现于重排的Ig基因位点。点突变除了大幅增加抗体库多样性外,还使得对特定抗原具有高亲和力的免疫球蛋白出现。
与其他抗体同种型类似,IgY除了可变区具有抗原中和能力外,Fc区也具有相当一部分的免疫调节功能。IgY的Fc区是Gallus Gallus Fc受体(ggFcR)和鸡免疫球蛋白样受体簇(CHIR)及其同源物的配体。在属于CHIR簇的受体中,研究最多的是CHIR-AB1。IgY-ggFcR相互作用类似于受体配体比例为1∶1的IgG-Fc-FcγR相互作用,而IgY-CHIR-AB1相互作用类似于受体配体比例为2∶1的IgA-FcαR1受体相互作用。
由于残基基团和/或结构构象的差异,IgY的Fc区不能与哺乳动物的Fc受体、类风湿因子(RF)、CF(尤其是C1q和C3)以及蛋白A、蛋白G、蛋白L发生相互作用。由于IgY不能与上述哺乳动物免疫调节蛋白结合,可以避免免疫测定中哺乳动物免疫复合物的天然相互作用所带来的显著干扰和交叉反应。使用IgY还可以避免哺乳动物Ig的疗法可能产生的不良继发免疫反应。此外,加深对IgY与鸡免疫调节蛋白的相互作用的理解可以进一步优化多克隆/单克隆IgY检测或纯化方法。如可以通过CHIR1-AB1-哺乳动物Fc融合蛋白来简化IgY检测方法:使用预制或商业化的抗哺乳动物Fc二抗检测抗原结合的IgY,这样无需制备或购买新的抗IgY二抗。
表1 IgY、IgG和IgE与特定受体/配体的不同相互作用区域
| 受体和/或配体 | 相互作用区域/特征 | ||
|---|---|---|---|
| IgY | IgG | IgE | |
| CHIR-AB1 | CH3-CH4域间 | – | – |
| ggFcR | CH2-CH3域间 | – | – |
| FcRY | CH3-CH4域间 | – | – |
| IgG-FcγR | – | CH2-CH3域间,CH2铰链区 | – |
| IgE-FcεR | – | – | CH3-CH4域间 |
| 类风湿因子(RF) | – | CH2-CH3域间 | 可能为CH3-CH4域间 |
| 补体因子(CF) | – | CH2-CH3域间,CH2铰链区 | – |
| 蛋白A | – | CH2-CH3域间,可能涉及CH2铰链区 | CH2 N端 |
| 蛋白G | – | CH2-CH3域间 | – |
| 蛋白L | – | Kappa轻链 | Kappa轻链 |
IgY具有高稳定性,在室温下可保持活性6个月,在4°C下可保持活性5年,在70°C下可以保持相对稳定15分钟;并且在pH值为4~11时具有高活性。有研究从结合活性和构象变化两方面比较兔IgG和鸡IgY的分子稳定性。结果发现,与兔IgG相比,鸡IgY在碱性和酸性pH下表现出更高的稳定性,同时在高温条件下(45℃,60℃)保持稳定的时间更长。IgY重链上的额外结构域在提供更高的分子稳定性方面发挥了重要作用。
参考文献
[1]Wu L, Oficjalska K, Lambert M, et al. Fundamental Characteristics of the Immunoglobulin VH Repertoire of Chickens in Comparison with Those of Humans, Mice, and Camelids. The Journal of Immunology, 2012, 188(1): 322-333.
[2]Lee W, Syed Atif A, Tan SC, et al. Insights into the chicken IgY with emphasis on the generation and applications of chicken recombinant monoclonal antibodies. J Immunol Methods, 2017, 447: 71-85.
[3]Yakhkeshi S, Wu R, Chelliappan B, et al. Trends in industrialization and commercialization of IgY technology. Front Immunol. 2022, 13:991931.
[4]Gandhi S, Alshehri SM. Molecular stability of the rabbit and chicken egg yolk immunoglobulins. Front Biosci (Elite Ed), 2021,13(1):185-194.

澳门威斯人游戏平台[亚洲]全站最新版V11.37.7 Nanjing Detai Bioengineering Co.,Ltd. ©2024 All Rights Reserved
苏ICP备2021019379号-1 | 网站地图 | 用户协议 | 隐私政策