细胞生长曲线绘制-细胞计数法
摘要:细胞生长曲线的绘制方法多种,本文主要介绍通过细胞计数法绘制生长曲线,帮助我们更好的了解细胞的生长状态及活力,从而指导下游实验操作。
细胞计数法绘制生长曲线,是细胞培养研究中常用的技术手段。原理就是通过测定单位体积内的细胞数量,得到细胞的总浓度进而计算出细胞总数。
典型的细胞生长曲线分为四个时期:延滞期,指数期,稳定期和衰亡期。不同时期的细胞生长状态和性能各不相同。通过测定生长曲线,可以测定细胞绝对生长数,判断细胞活力,可用于测定药物等外来因素对细胞生长的影响,有助于我们选择该时期的细胞进行细胞下游实验(瞬时转染或稳定转染)。以下介绍细胞计数的主要方法和注意点:
实验准备
- 仪器:二氧化碳培养箱,显微镜,超净工作台,血球计数板
- 试剂:胰蛋白酶,培养基(血清)
实验操作
- 取生长良好的细胞,用胰蛋白酶消化,离心
- 离心后去上清,加入新鲜适量的培养基重悬细胞,使之成为单细胞悬液
- 按照一定的倍数稀释该单细胞悬液,稀释倍数以稀释结果细胞数在20-200之间为合适倍数
- 准备血球计数板,洗净晾干
- 吸取一定量的细胞悬液,加样到血球计数板上,显微镜下计数
- 按照血球计数板的计数原理进行细胞计数
- 计算细胞总数, 调整细胞至一定浓度(1×105/ml)。细胞浓度=细胞计数板得到的细胞数量/4x稀释倍数x104/ml
- 细胞再培养,准备24孔板,每孔中加入0.1ml的细胞(即1×104个细胞)和0.9ml的细胞培养基,轻轻晃动孔板(十字方向晃动),使细胞分布均匀,并进行常规细胞培养(48h后换液培养)
- 培养48h后,即可每过24h取样一次,每次取样至少取3个孔的细胞,多次计数取平均值,提高准确性),取样细胞常规胰蛋白酶消化,制备单细胞悬液,显微镜下进行细胞计数
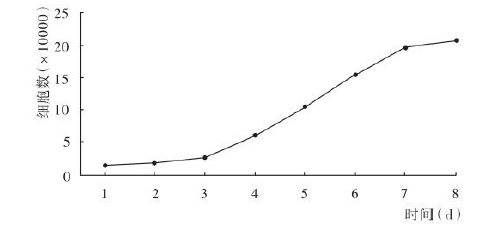
- 计数结果,以时间(d)为横坐标,细胞数为纵坐标,绘制细胞生长曲线
结果分析
根据培养的时间和细胞计数的结果得到如下图,细胞培养初始几天生长缓慢,为延滞期。两到三天之后细胞进入对数生长期,此时细胞生长最为旺盛,细胞活力也相对最佳,通常在我们的细胞转染或构建稳定细胞系时选择对数生长期的细胞。一段时间后细胞进入稳定生长时期
操作要点
- 细胞用胰蛋白酶消化,消化时间要自己把握,时间短细胞消化不好形成团状,时间长细胞死亡率可能会增加,制备成单细胞悬液即可
- 细胞计数时,按照计数原理数细胞,每个大方格中的细胞大于200小于20,则稀释倍数不适,需重新稀释。在消化细胞计数之前,可自己估算培养瓶中的总细胞数,这样可以预估下稀释的倍数,避免重新稀释
- 细胞接种时细胞摇均匀,接种按照十字方向晃动,晃动时间可以延长,以避免形成细胞团为准,但要防止细胞液溅出
- 细胞培养易被污染,污染原因也多种多样,实验室环境,细胞自身原因,如果为菌类污染建议丢弃重新复苏培养,更多相关情况及解决可参考资料专区细胞培养FAQ
细胞计数法绘制生长曲线,操作相对简便。此外,MTT比色实验也能检测细胞的存活和生长,得到细胞生长曲线,且灵敏度高,重复性好,具体原理和操作见MTT法绘制生长曲线。
![澳门威斯人游戏平台[亚洲]全站最新版V11.37.7](/wp-content/themes/2023/images/banner/technical-resources.jpg?v=18)

