![澳门威斯人游戏平台[亚洲]全站最新版V11.37.7](/wp-content/themes/2023/images/banner/technical-resources.jpg?v=18)
酶免疫组织化学技术(enzyme immunohistochemistry technique,EIT)是免疫组织化学中最常用的方法之一,是在一定的条件下,应用酶标记抗体(抗原)与组织或细胞标本中的抗原(抗体)发生特异性免疫反应,在酶的催化作用下催化底物产生显色反应,通过显微镜观察标本中抗原(抗体)的分布位置和性质,也可通过图像分析技术达到定量的目的。
酶免疫组织化学具有以下优点:①无需特殊显微镜设备;②定位准确,且对比度好;③酶标染色标本可长期保存;④可使用苏木素-伊红染料复染,与形态学相结合,便于观察结果;⑤显色反应的底物易分辨,电子密度大,便于光镜及电镜观察;⑥根据酶和底物的不同显示不同颜色,可进行双重或多重染色。尤其是非标记抗体酶法的灵敏度更优于荧光免疫技术。由于以上优点使酶免疫组织化学技术成为临床病理诊断、肿瘤性质判断及预后观察的重要手段。
酶标记抗体
借助交联剂共价键将酶直接连接在抗体上形成酶标抗体,酶标抗体与靶抗原反应后,通过酶对底物的特异性催化作用,生成不溶性有色产物。常用的方法有直接法和间接法。
①直接法:将酶直接标记在特异性抗体上,与组织细胞内相应抗原进行特异性反应,形成抗原-抗体-酶复合物,最后用酶底物显色。直接法操作简便但灵敏度低,此外需要依据不同抗原制备相应的酶标抗体。
②间接法:将酶标记在第二抗体上形成酶标二抗,先将第一抗体(特异性抗体)与相应的组织抗原结合,形成抗原抗体复合物,再用第二抗体(酶标二抗)与复合物中的特异性抗体结合,形成抗原-抗体-酶标二抗复合物,最后用底物显色剂显色。间接法检测灵敏度高,制备一种酶标二抗可用于检测多种抗原或抗体,但特异性不如直接法,可能会出现假阳的情况。
非酶标记抗体
非酶标记抗体技术使用酶免疫动物,制备效价高、特异性强的抗酶抗体,通过免疫学反应使得抗酶抗体与组织抗原结合。该方法避免了酶标记时对抗体的损伤,同时也提高了方法的灵敏度。它有以下几种技术类型:
①酶桥法
抗酶抗体作为第三抗体,通过桥联抗体(第二抗体),将特异性识别组织抗原的第一抗体与第三抗体连接起来,形成酶联的抗原-抗体复合物,加底物显色。酶桥法较酶标法的灵敏度有所提高,但操作更为复杂。在酶桥法中,如果抗酶抗体与酶结合弱,在操作中酶常被冲洗掉;如果酶标记在非特异性抗体上就会存在背景着色问题;同时抗酶抗体的非特异性成分也能竞争结合桥联抗体的结合位点,影响方法的灵敏度。
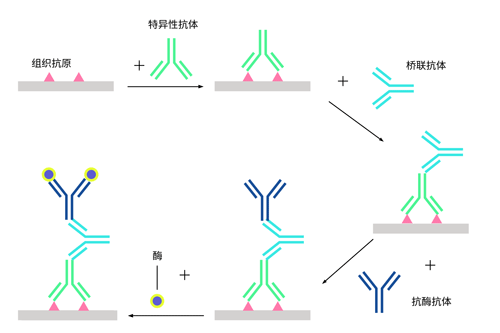
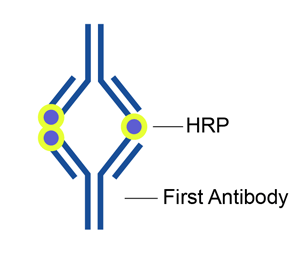
图 1 PAP复合物
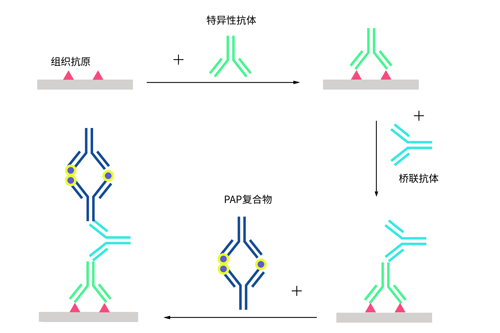
与酶桥法相比,PAP复合物结构稳定,避免了酶桥法中酶标记易脱落的弊端;灵敏度高,较桥酶法灵敏20倍;PAP是一种复合物,无游离免疫球蛋白存在,不易引起非特异性染色。
(三)双桥PAP法
双桥PAP法的基本原理是通过两次连接桥联抗体和PAP复合物,使得双桥可结合更多的PAP复合物于抗原分子,以增强灵敏度。这种使用桥联抗体放大的方法,使桥联抗体与PAP复合物中抗酶抗体的未饱和Fc段结合,或桥联抗体与特异性第一抗体尚未饱和的Fc段结合,从而达到对抗原的明显放大效果,对于组织细胞微量抗原的检测有实用价值。

参考文献
[1]王兰兰,许化溪.临床免疫学检验(第5版)[M].北京:人民卫生出版社,2012
[2]吴秉铨,刘彦仿.免疫组织化学病理诊断[M].北京科学技术出版社,2007.

澳门威斯人游戏平台[亚洲]全站最新版V11.37.7 Nanjing Detai Bioengineering Co.,Ltd. ©2024 All Rights Reserved
苏ICP备2021019379号-1 | 网站地图 | 用户协议 | 隐私政策