![澳门威斯人游戏平台[亚洲]全站最新版V11.37.7](/wp-content/themes/2023/images/banner/technical-resources.jpg?v=18)
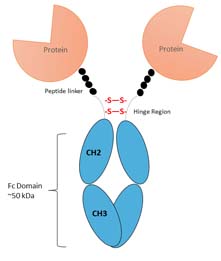 Fc融合蛋白是指利用基因工程技术将免疫球蛋白(IgG、IgA等)的Fc段与某种具有生物学活性的功能蛋白分子融合而产生的新型蛋白。具有生物学活性的功能蛋白可以是细胞因子、毒素、受体、酶、抗原肽等。Fc融合蛋白不仅可发挥所融合蛋白的生物学活性,还具有一些抗体的性质,如可引起抗体依赖细胞介导的细胞毒作用(ADCC)、补体依赖的细胞毒作用( CDC)与抗体依赖细胞介导的吞噬作用(ADCP)等。
Fc融合蛋白是指利用基因工程技术将免疫球蛋白(IgG、IgA等)的Fc段与某种具有生物学活性的功能蛋白分子融合而产生的新型蛋白。具有生物学活性的功能蛋白可以是细胞因子、毒素、受体、酶、抗原肽等。Fc融合蛋白不仅可发挥所融合蛋白的生物学活性,还具有一些抗体的性质,如可引起抗体依赖细胞介导的细胞毒作用(ADCC)、补体依赖的细胞毒作用( CDC)与抗体依赖细胞介导的吞噬作用(ADCP)等。
蛋白类药物在血浆内半衰期较短,为了达到治疗效果需要大剂量给药,这样会造成严重的副作用,给患者造成巨大的负担。将功能蛋白与免疫球蛋白的Fc段融合,可以延长药物在血浆内的半衰期,降低药物的免疫原性,在疾病的诊断与治疗方面有重要的意义。
Fc融合蛋白由免疫球蛋白的Fc段与具有生物学活性的蛋白分子组成。Fc段与功能蛋白具有相对独立的结构域与功能,能够从不同角度影响融合蛋白的理化性质与生物学活性。
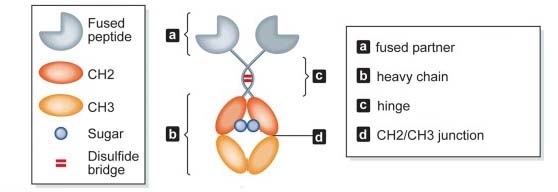
图1:Fc融合蛋白结构
Fc融合蛋白最主要的特点是包含Fc段,与单克隆抗体中Fc段功能类似,融合蛋白的Fc段可以起到延长功能蛋白在血浆内的半衰期、提高分子的稳定性、特异性结合体内的Fc受体,并发挥相应的生物学功能等作用。除此之外,Fc段可以特异性结合protein A,简化了Fc融合蛋白的纯化步骤,在相关生物制品的研发制备具有重要意义。
人体内的免疫球蛋白依赖于Fc段与新生Fc受体(FcRn)的结合,在FcRn的保护下,半衰期可以长达19~21d。与此类似,Fc融合蛋白也能依赖此原理延长在体内的半衰期:Fc段与FcRn的结合呈pH依赖性,在pH7.4的生理条件下,FcRn与Fc不结合;在细胞内涵体pH 6.0~6.5的酸性条件下,两者结合,从而避免了融合蛋白在细胞内被溶酶体等快速降解。除此之外,Fc段能够增大分子体积,降低肾清除率,也从一定程度上延长了半衰期。
Fc融合蛋白可以通过Fc铰链区的二硫键链接形成稳定的二聚体。通过对二硫键进行进一步的基因工程改造,还可以使Fc融合蛋白形成更加稳定的六聚体复合物。另外,Fc区域可以独立折叠,保证了分子的稳定性。
将Fc段与功能蛋白融合,可提高蛋白在哺乳动物中的表达分泌,同时Fc段可以与protein A发生特异性结合,有利于融合蛋白的纯化。
Fc融合蛋白的FC结构域可与免疫细胞表面的Fc受体结合,发挥多种生物学功能(见表1),如介导穿过胎盘和粘膜屏障、炎症反应、抗体依赖细胞介导的吞噬作用(ADCP)、抗体依赖细胞介导的细胞毒作用(ADCC)、补体依赖的细胞毒作用(CDC),促进树突状细胞(DC)成熟,调节细胞因子分泌,调节B细胞增殖分化等。
表1:主要的Fc受体及相应的生物学功能
| 受体 | 抗体配基 | 细胞分布 | 配基亲和力(L/mol) | 效应 |
| FcγRⅠ(CD64) | IgG | 单核细胞、巨噬细胞等 | 107~105 | 噬菌作用,细胞激活,介导ADCC效应 |
| FcγRⅡa(CD32) | IgG | 巨噬细胞、中性粒细胞等 | <107 | 噬菌作用,脱颗粒作用,介导ADCC效应 |
| FcγRⅡb(CD32) | IgG | B细胞、单核细胞等 | <107 | 抑制细胞激活作用 |
| FcγRⅢa(CD16a) | IgG | 巨噬细胞、单核细胞等 | 2×107 | 介导ADCC效应,促巨噬细胞分泌细胞因子 |
| FcγRⅢb(CD16b) | IgG | 中性粒细胞、嗜酸细胞等 | <107 | 诱导杀菌作用 |
| FcεRⅠ | IgE | 肥大细胞、嗜碱细胞等 | >1010 | 脱颗粒作用,促炎症介质或细胞因子释放 |
| FcεRⅡ(CD23) | IgE | B细胞、T细胞等 | 106 | 调节作用 |
| FcαRⅠ(CD89) | IgA | 中性粒细胞、单核细胞等 | 2*107 | 噬菌作用,介导ADCC效应 |
| FcRn | IgG | 上皮细胞、内皮细胞 | 2*108 | 将母体IgG转运到胎儿体内;保护IgG免受降解 |
Fc融合蛋白的Fc结构域影响了融合蛋白分子的理化性质与生物学活性,而功能蛋白部分则决定了Fc融合蛋白的药理活性。功能蛋白的种类很多,可以是细胞因子、毒素、受体、酶等,其作用也各不相同。功能蛋白的作用主要有:抗炎性感染、抗病毒感染、抗瘤免疫、防止溶骨、抗移植排斥、治疗痛觉过敏、自身免疫性疾病的治疗等。
大部分Fc融合蛋白药物的作用机制为受体与配体之间的相互作用,同时辅以Fc片段的多种生物学功能。截止2014年9月,已有9种人IgG-Fc融合蛋白药物经美国食品及药品监督管理局(FDA)批准临床使用,包括治疗甲型血友病药物抗血友病因子Fc融合蛋白(Eloctate,2014)、移植排斥药物Belatacept(Nulojix,2011)、乙型血友病的药物凝血因子IXFc融合蛋白(Alprolix,2014)、年龄相关性黄斑变性药物Aflibercept(Eylea,2011)、CAPS药物Rilonacept(Arcalyst,2008)、慢性免疫性血小板减少性紫癜药物Romiplostim(Nplate,2008)、风湿性关节炎药物Abatacept(Orencia,2005)和Etanercept(Enbrel,1998)以及银屑病和移植排斥药物Alefacept(Amevive,2003)。除了上述已成功转化的临床应用的Fc融合蛋白外,有更多的Fc融合蛋白药物处于临床研究中 。
另外,Fc融合蛋白也可以作为一种新型疫苗形式,将病原体的部分抗原肽与IgG-Fc片段进行融合,诱导机体产生抗原特异性免疫应答。研究表明,HIV-1 Gag p24、gp120 V3以及流感病毒HA胞外域与小鼠IgG2a-Fc的融合疫苗,可提高小鼠抗原特异性体液免疫反应。
Fc融合蛋白较传统蛋白类药物具有多种新特性,在全世界范围内受到广泛关注,但Fc融合蛋白本身也存在许多局限,如价格昂贵、不可口服给药等。随着相关技术与理念的不断进步,Fc融合蛋白在临床治疗、医学生物研究等领域必将发挥更大的作用。

澳门威斯人游戏平台[亚洲]全站最新版V11.37.7 Nanjing Detai Bioengineering Co.,Ltd. ©2024 All Rights Reserved
苏ICP备2021019379号-1 | 网站地图 | 用户协议 | 隐私政策