![澳门威斯人游戏平台[亚洲]全站最新版V11.37.7](/wp-content/themes/2023/images/banner/technical-resources.jpg?v=18)
兔单抗凭借其精细的表位识别、高亲和力、高特异性和稳定性,已成为研究、诊断和治疗应用中的杰出试剂。这些特性也使兔子成为抗体体内发现极具吸引力的替代品。兔抗与其他物种的抗体相比,结构也略有不同。兔IgG一个显著特征就是存在非经典二硫键。这些键常见于kappa链Cys80和Cys170(C80-C170)之间,以及重链CDR1 Cys35a和CDR2 Cys50(C35a-C50)之间。已有研究对C80-C170二硫键进行表征,并发现此二硫键的存在有助于提升抗体的热稳定性。与C80-C170二硫键不同,含有C35a-C50二硫键的兔单抗通常被认为具有一种“负担”,即使其他方面的性能符合要求,通常也会被排除于临床治疗候选抗体之外。
程序性死亡受体1(PD-1)是重要的免疫检查点受体,通过与两个配体PD-L1和PD-L2的作用抑制T细胞的活化及细胞因子的产生,已被证实是癌症免疫疗法最有前途的靶点之一。临床前小鼠模型是进行药效、药代动力学和毒性研究的重要工具,但开发出人鼠交叉的PD-1抗体难度较高。研究人员利用单B细胞抗体发现平台开发了抗PD-1兔单抗,但筛选出的所有人鼠交叉且阻断PD-L1的PD-1抗体都含有C35a-C50二硫键,这表明这种二硫键可能具有某些功能作用,并且可能影响这些候选抗体在人源化后的进一步发展。
这些兔单抗与人PD-1(hPD-1)和食蟹猴PD-1(cynoPD-1)具有相似的亲和力,对小鼠PD-1(mPD-1)的亲和力范围更广,且大多数对hPD-L1和mPD-L1显示完全阻断(最大抑制作用大于90%)。同时,这些兔单抗还与hPD-1和mPD-1高表达细胞株具有较强的结合。通过对hPD-1的表位分析(epitope binning)发现,所有具有交叉反应的抗体都聚集在同一个分箱中,并与帕博利珠单抗(pembrolizumab)的表位重叠。
为了进一步了解这种重链间非经典二硫键对抗体稳定性和抗原结合活性的影响,研究人员选择了其中一株亲和力最高的人鼠交叉PD-L1阻断兔单抗(rbt1340),并将这株抗体人源化,选取了对三种PD-1表现出最高的亲和力,且对hPD-1/hPD-L1和mPD-1/mPD-L1相互作用的抑制作用最高的一株人源化兔单抗(h1340.CC,CC指包含C35a-C50二硫键)。研究人员还制备了去除了C35a-C50二硫键的h1340.CC变体h1340.SA:将C35a突变为丝氨酸,将C50突变为丙氨酸。结果发现,与rbt1340相比,h1340.CC在物种间的亲和力损失仅为2~3倍,h1340.SA对人、食蟹猴和小鼠PD-1的亲和力分别降低了4倍、6倍和10倍。
表1 rbt1340、h1340.CC、h1340.SA与三种PD-1的亲和力
| Antibody | Human PD-1 KD/nM | Cyno PD-1 KD/nM | Mouse PD-1 KD/nM |
|---|---|---|---|
| rbt1340 | 0.18 | 0.24 | 0.67 |
| h1340.CC | 0.3 | 0.42 | 1.72 |
| h1340.SA | 0.72 | 1.3 | 7.1 |
在分辨率为2.3 Å条件下对h1340.CC Fab与hPD-1结合的晶体结构进行解析,从残基Arg30到Arg143对PD-1进行建模(对应于残基59-60、71-72和85-92的无序loop区除外),结果观察到h1340.CC Fab和PD-1之间存在广泛的结合界面,且与PD-L1的结合界面部分重叠。h1340.CC的所有CDR参与与PD-1的结合,并与PD-1形成三个主要的相互作用界面。
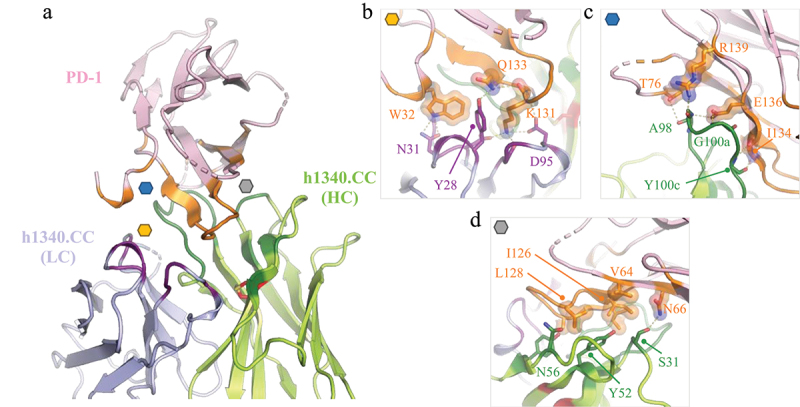
图1 h1340.CC Fab与hPD-1结合构象
第一主要相互作用界面由PD-1残基Trp32、Lys131和Gln133形成,它们在由CDR L1、L2、L3和H3残基形成的口袋中结合(图1b)。PD-1残基Trp32和Gln133分别与CDRL1 残基Asn31和Tyr28形成氢键。其他关键接触涉及PD-1残基Lys131,它与CDRL3 Tyr92骨架羰基形成氢键,并与CDRL1残基Asp32和CDRL3残基Asp95形成盐桥,而PD-1残基Ala132与CDRL3 Asp95形成氢键。
第二个界面由侧链形成——PD-1残基Thr76、Glu136和Arg139与CDRH3残基Ala98、Gly99和Gly100a之间的极性相互作用,以及PD-1残基Ile134和CDRH3残基Tyr100c之间的氢键(图1c)。
最后,PD-1残基Asn66和CDRH1残基Ser31之间的氢键以及PD-1(残基Val64、Ile126、Leu128、Ala132和Ala134)上的疏水斑块与CDRH1、H2和H3的芳香基团和极性基团的脂肪族部分相互作用,形成了第三个主要相互作用界面(图1d)。
人、食蟹猴和小鼠PD-1的序列分析解释了h1340.CC物种交叉反应的原因:hPD-1与h1340.CC Fab CDR直接接触的关键残基在cyno PD-1中都是保守的,而在mPD-1中,这些残基中存在三处不同(图2)。事实上mPD-1中保守的Gln133Lys取代可能可以保持与CDRL1残基Asn31的氢键,但Tyr68Asn和Arg139Gly取代可能导致CDRH1和CDRH3失去两个氢键。

图2 人、食蟹猴和小鼠PD-1的表位比较
半胱氨酸残基C35a和C50位于面向轻链的相邻β折叠股中,不参与与hPD-1的任何直接相互作用。但二硫键对CDRH3残基L100e和L100h具有支撑作用,可能在稳定CDRH3构象及其与hPD-1的广泛相互作用界面上发挥重要作用(图3)。此外,在靠近二硫键的地方,CDRH1残基W34和CDRH2残基Y52与hPD-1残基Ile126、Leu128、Ala132和Ile134形成疏水斑块。
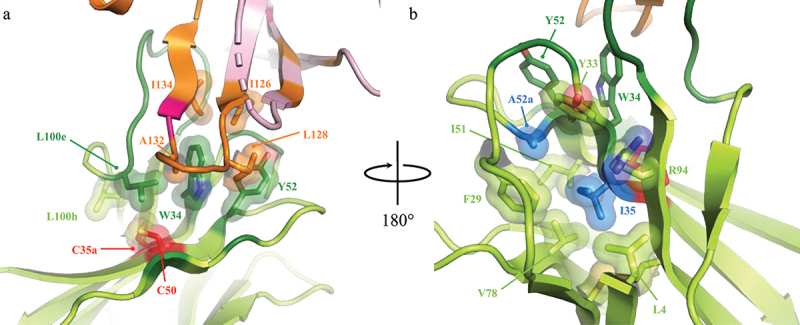
图3 h1340.CC二硫键的结构背景
h1340.CC重链以淡绿色表示,其关键残基以深绿色表示;C35a-C50二硫键用红色表示;与hPD-1残基Ile126、Leu128、Ala132和Ile134形成疏水相互作用的关键残基以球棍模型表示;人类和小鼠PD-1的不同残基(Y68N和Q133K)用亮粉色表示。
在理解相互作用结构的基础上,研究人员试图减轻去除非经典C35a和C50二硫键而导致的亲和力损失。去除二硫键可能会影响CDRH1-H2区域向CDRH3残基L100e和L100h的折叠,从而影响CDRH1或H2、H3构象,导致与hPD-1结合的变化。如前所述,突变C35a→S和C50→A导致对mPD-1的亲和力降低~4倍,但对hPD-1的亲和力仅降低~2.5倍。从序列结构的分析来看,没有明显的理由在去除二硫键后,与mPD-1的结合比hPD-1的结合损失更多,这可能是由于mPD-1中Y68N和R139G的差异,两个氢键的潜在丢失可能使mPD-1更容易受到去除二硫键导致的弱相互作用的影响。
综上,研究人员将C35、C50两个位置上突变为疏水性氨基酸(Val、Ile和Leu),此外还尝试将C50保守突变为Ser或Thr 5个变体。结果发现,与h1340.SA相比,这些变体均未产生更高的亲和力。
进一步的结构分析发现,将残基I35和/或A52a突变为较大的残基可能可以改善疏水核心的折叠,从而支撑β折叠,改善或稳定W34和Y52与hPD-1的相互作用。通过将h1340.SA、h1340.VS(C35a→V,C50→S)的I35突变为Leu或Met,A52a突变为Val、Ile或Leu,进一步测试变体的亲和力。具有额外突变I35→L和A52a→V的h1340.SA变体(h1340.SA.LV)对hPD-1的亲和力在亲本克隆h1340.CC两倍内得到改善。
通过表面等离子体共振(SPR)比较h1340.CC与h1340.SA.LV和hPD-1、CynoPD-1和mPD-1的亲和力活性,发现KD值差异小于2.5倍。
表2 h1340.CC和h1340.SA.LV与三种PD-1的亲和力
| Antibody | Human PD-1 KD/nM | Cyno PD-1 KD/nM | Mouse PD-1 KD/nM |
|---|---|---|---|
| h1340.CC | 0.45 ± 0.07 | 0.63 ± 0.14 | 1.91 ± 0.23 |
| h1340.SA.LV | 0.80 ± 0.05 | 1.51 ± 0.08 | 3.82 ± 0.11 |
通过FACS评估两株抗体在与hPD-1、mPD-1高表达细胞株结合活性及在阻断PD-1/PD-L1相互作用方面的表现,发现其与上市药物帕博利珠单抗和纳武利尤单抗(Nivolumab)具有相似的IC50。
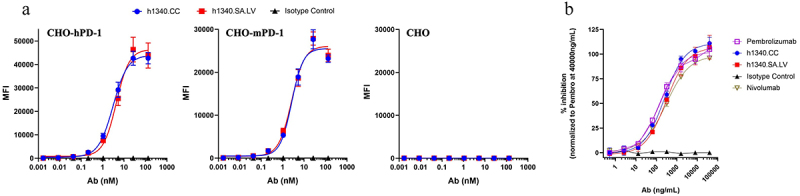
图4 h1340.CC和h1340.SA.LV在结合和阻断方面的功能表征
评估两株抗体的潜在免疫原性是通过FACS检测健康供体的外周血单一核细胞(PBMC)与抗体共孵育7天后CD4 T细胞的增殖情况。使用刺激指数(SI),即存在或不存在测试抗体时BrdU/CD3CD4 T细胞的百分比比率确定每个供体的反应。结果表明,两株抗体在阳性供体中诱导的T细胞增殖具有相似的SI值(13~17%),即都具有低免疫原性潜力。
抗体可开发性评估主要包括抗体的热稳定性、化学稳定性、黏度与浊度。
在高浓度(150 mg/mL)下对h1340.CC和h1340.SA.LV进行热稳定性检测,并评估其转化为高浓度制剂的可能性。在30°C下储存一个月后,通过尺寸排阻色谱法(SEC)评估了抗体的聚体和片段化程度,并通过离子交换色谱法(IEC)评估了电荷异构体的变化。尽管非经典二硫键可能导致半胱氨酸不成对或二硫键乱配,从而导致抗体聚集,但实际上未观察到h1340.CC的聚集增加。此外,虽然h1340.SA.LV IEC观察到主峰的降幅更大,但这种变化在测定变异性范围内,表明两种变体在高浓度热应力下表现相似。
使用2,2′-偶氮二(2-脒基丙烷)二盐酸盐(AAPH)对两株抗体进行化学胁迫时,可以观察到h1340.SA.LV在W34处的氧化高于h1340.CC(分别为36%和1%),表明该区域的溶剂可及性增加。根据结构分析,该残基与非经典二硫键的紧密接近,去除二硫键会破坏该区域的稳定性并增加CDRH1环的灵活性。在热应激或氧化应激后,通过肽图分析未观察到任何天冬酰胺、天冬氨酸、蛋氨酸或色氨酸残基在任一变体的CDR中的氧化差异。
除了热稳定性和化学稳定性外,抗体的黏度也是影响生产过程的关键特性。在高离子强度缓冲液中测量了两株抗体在高浓度下的黏度,h1340.CC的黏度略高于h1340.SA.LV,都远低于不可开发的黏度阈值,因此不会对生产过程构成风险。
最后,为了了解对给药的影响,将高浓度样品透析到PBS中来评估两株抗体的溶解度,透析后测量的浊度没有观察到差异。
表3 h1340.CC和h1340.SA.LV的理化性质分析
| Antibody | SEC | IEC | 黏度cP | 浊度OD | ||||
|---|---|---|---|---|---|---|---|---|
| 高分子量形式变化/% | 单体变化/% | 低分子量形式变化/% | 酸性变化/% | 主峰变化/% | 碱性变化/% | |||
| h1340.CC | 0.9 | −1.3 | 0.4 | 5.0 | −7.0 | 2.0 | 13.0 | 0.22 |
| h1340.SA.LV | 0.8 | −1.2 | 0.4 | 6.7 | −7.7 | 1.0 | 11.0 | 0.22 |
研究人员同时利用ProteinMPNN,一种基于深度学习的蛋白质序列设计算法设计抗体序列。ProteinMPNN使用蛋白质骨架特征作为输入,根据计算机生成或实验得出结构生成新的氨基酸序列。使用h1340.CC Fab与hPD-1结合结构作为输入,并保持hPD-1和h1340.CC的轻链序列固定,生成h1340重链序列。生成的重链序列约有一半的含有C35a-C50二硫键,22%的序列在残基35a-50处含有丙氨酸-丙氨酸对,而只有11%的序列含有丝氨酸-丙氨酸对,也就是使用序列分析方法中所获得的最优变体。
表4 ProteinMPNN设计的h1340重链中35a-50残基对频率
| 变体名称 | 35a−50残基对 | 频率/% |
|---|---|---|
| h1340.CC | Cys-Cys | 47 |
| h1340.AA | Ala-Ala | 22 |
| h1340.SA | Ser-Ala | 11 |
| h1340.VA | Val-Ala | 9 |
| h1340.GA | Gly-Ala | 6 |
| h1340.LA | Leu-Ala | 5 |
重点关注含有AA、SA和VA残基对,且突变发生频率大于等于50%的序列。排除暴露于溶剂、远离抗原结合位点、可能会降低亲和力的残基,最终保留了6个突变位点。
检测生成变体与hPD-1的亲和力发现(表5),单个位点突变变体中(h1340.SA.1-6)有三个变体亲和力高于h1340.SA(图5):突变S30→D可能与PD-1残基K78产生强氢键,K78在人、小鼠和食蟹猴中保守;与A52a→V类似,A52a→L突变可以改善疏水核心的折叠,支持CDRH1关键残基W34和CDRH2关键残基Y52与PD-1的相互作用;A95→S突变可以与T100d的羰基骨架产生氢键,从而形成CDRH3环状构象。
表5 基于结构和机器学习设计的h1340.CC变体的相对亲和力
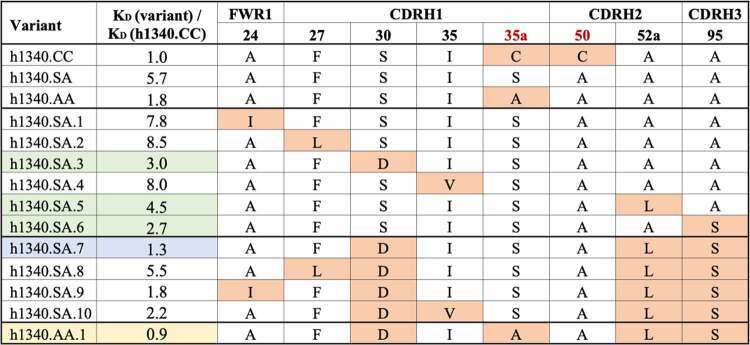
*与h1340.SA相比,变体的序列差异以橙色突出显示;单个残基突变的变体亲和力提高以绿色突出显示;SA或AA骨架的最佳变体分别以蓝色和黄色突出显示。
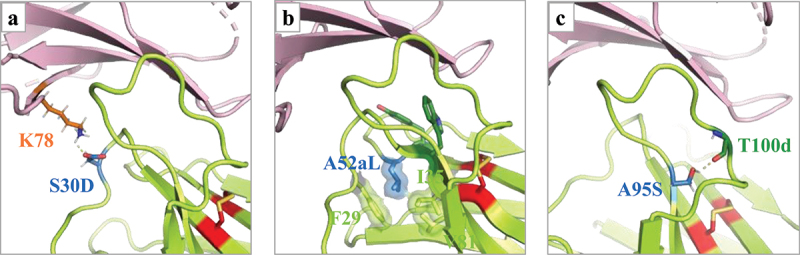
图5 基于结构和机器学习设计变体的结构分析
h1340.SA.7和h1340.AA.1与初始的h1340.CC亲和力比较分析表明,两种变体与hPD-1和cyno PD-1的亲和力损失小于1.5倍,与mPD-1的亲和力损失小于2.5倍。综上,基于结构和机器学习的二硫键去除可以快速有效地生成具有改进特性的抗体变体。
表6 h340.SA.LV、h1340.SA.7和h1340.AA.1与三种PD-1的亲和力
| Antibody | Human PD-1 KD(nM) | Cyno PD-1 KD(nM) | Mouse PD-1 KD(nM) |
|---|---|---|---|
| h1340.CC | 0.45 ± 0.07 | 0.63 ± 0.14 | 1.91 ± 0.23 |
| h1340.SA.LV | 0.80 ± 0.05 | 1.51 ± 0.08 | 3.82 ± 0.11 |
| h1340.SA.7 | 0.62 ± 0.03 | 1.05 ± 0.09 | 3.66 ± 0.35 |
| h1340.AA.1 | 0.60 ± 0.08 | 1.09 ± 0.18 | 4.34 ± 0.48 |
非经典二硫键在兔、鸡、骆驼、鲨鱼和牛抗体中普遍存在,它们在产生多样化的抗体库中起着至关重要的作用,扩大互补位空间,介导与抗原之间不同结构和功能相互作用。之前普遍认为,为了将源自这些物种的有价值的单克隆抗体改造为治疗药物,在药物开发过程中必须去除CDR内部和外部的非经典二硫键。在兔单抗中,轻链结构域之间的非经典C80-C170二硫键可以很容易地通过丙氨酸诱变去除,不会对蛋白表达及构建体外噬菌体展示的免疫文库而使用特定品系的动物(Basilea兔和b9兔)产生不利影响。相比之下,重链CDR1和CDR2之间的非经典C35a-C50二硫键不易去除。因此,尽管在其他方面具有良好的特性,此类抗体通常不会被优先考虑。事实上,在去除含有非经典C35a-C50二硫键的抗PD-1兔源单克隆抗体的过程中发现,通过结构序列分析及机器学习的方法可以快速有效改善抗体特性,也证明了兔单抗中发现的非经典二硫键并不一定构成治疗性抗体开发的阻碍。正确的评估兔源性抗体的可开发性,减少对兔源性抗体成药性的偏见可以丰富候选抗体分子数量,从而筛选到更优的临床候选药物。未来也需要更多的研究和临床验证证明结果的普遍性。
参考文献
Liang WC., Xi H, Sun D., et al. Structure-and machine learning-guided engineering demonstrate that a non-canonical disulfide in an anti-PD-1 rabbit antibody does not impede antibody developability. mAbs, 2024:16(1).

澳门威斯人游戏平台[亚洲]全站最新版V11.37.7 Nanjing Detai Bioengineering Co.,Ltd. ©2024 All Rights Reserved
苏ICP备2021019379号-1 | 网站地图 | 用户协议 | 隐私政策