![澳门威斯人游戏平台[亚洲]全站最新版V11.37.7](https://assets.detaibio.com/wp-content/themes/2023/images/banner/technical-resources.jpg?v=18)
生物药可能诱发适应性免疫反应,从而形成抗药抗体(ADA)。ADA的负面影响包括药物快速清除、药效丧失和过敏性休克。90%以上已批准的生物制剂会在研究的部分人群中诱发ADA。与原生人类蛋白相似性较低的产品诱导ADA的可能性会增加,其他因素也有可能影响ADA反应的发生,如配方、患者遗传学、患者病史和治疗方案。综上,ADA评价的目的有三个方面:了解药物疗效、药代动力学或不良事件是否与ADA的存在与否有关。例如,了解ADA是否会降低产品的循环浓度或血浆半衰期是一个重要的考虑因素,因为这些类型的ADA很可能会损害治疗药物的效果,并可能形成影响药物安全性的复合物。最后,了解ADA在治疗结果中的作用可为临床医生和研究人员提供设计或选择替代产品的机会,从而提高成功治疗的可能性。
ADA反应大致可分为两类:中和ADA(与药物产品结合并抑制药理功能)和非中和ADA(与药物结合但不直接抑制药物的理功能)。这两种类型的ADA都能通过诱导快速清除、阻止清除和增加生物利用度,或诱发其他免疫介导的结果(如细胞因子释放综合征、过敏反应或靶点耗竭)来改变药效。虽然不同药物和人群的ADA反应发生率差异很大,但检测灵敏度的提高已导致ADA检出率的增加,而且对其临床相关性的观察也各不相同。
ADA检测通常采用多层级的分析方法。首先使用高灵敏度筛选检测来确定样本中是否存在ADA,然后进行确证检测,以确定筛选检测中的阳性结果是否是由于特定的(可竞争的)相互作用所致。最后,进行滴度和/或功能检测(如中和、同种型、表位),以进一步确定ADA反应的特征并测量ADA反应的程度。在最初的检测试验中,可以采用各种测量蛋白-蛋白相互作用的方法,包括酶联免疫吸附试验(ELISA)、电化学发光(MesoScale Diagnostics)、微阵列(SQI Diagnostics)、固相(ImmunoCap)和珠基(Gyros, Luminex)试验。其他使用较少的方法包括表面等离子体共振、放射免疫沉淀和生物层干涉测量。无论采用哪种方法,灵敏度、对基质的耐受性以及循环治疗或治疗靶点的影响等因素都是需要考虑的重要因素。
评估和优化ADA检测方法其中一个挑战是阳性对照,通常是从免疫动物身上分离出来的单克隆抗独特型抗体,可以反映人类多克隆抗体反应的典型特征。虽然阳性对照通常不直接用于指定1级阳性阈值或切点,但它们在优化和描述检测性能方面的作用表明,了解不同阳性对照的表现,其对检测ADA的影响以及与研究结果之间的关系非常重要。阳性对照抗体克隆性、亲和力和靶标表位的差异都可能影响灵敏度,而阳性对照在循环药物存在时的功能又会进一步扰乱灵敏度。事实上,临床上越来越多地使用可延长血浆半衰期的抗体、可持续表达的新型基因递送方法以及其他新型长效注射技术,以延长治疗性抗体在循环中的存在时间。这种延长对ADA检测产生了影响,在开发检测方法时必须考虑到这一点。在药物存在的情况下,最广泛使用的ADA检测方法的信号可能会减弱或消失,从而导致假阴性结果。目前已开发出检测与治疗药物分离后的ADA的方法,但这些方法往往会对检测灵敏度、精确度和实用性造成影响。
ADA检测平台必须具有足够的灵敏度、稳健性和可重复性,才能在临床前及临床试验中发挥作用。采用多组药物和阳性对照在三种常用的检测平台ELISA,多重珠基免疫分析(MBA),电化学发光分析(ECL)进行性能检测评估,评估内容包括分析灵敏度(AS)或检测限(LOD)。各检测平台都采用桥连法进行检测,即抗体药物既用于固定ADA,又用于检测其存在。
检测药物选择临床阶段的六种HIV病毒特异性广谱中和治疗性抗体(10-1074,3BNC117,PGDM1400,PGT121,VRC01,VRC07)和一种双特异性治疗性抗体(10E8.4-iMab)。10E8.4-iMab和PGT121两种产品各有两种不同的抗独特型抗体,VRC01和VRC07两种产品共用一种抗独特型抗体。各平台抗独特型抗体与药物桥连的浓度依赖能力结果如图1所示。
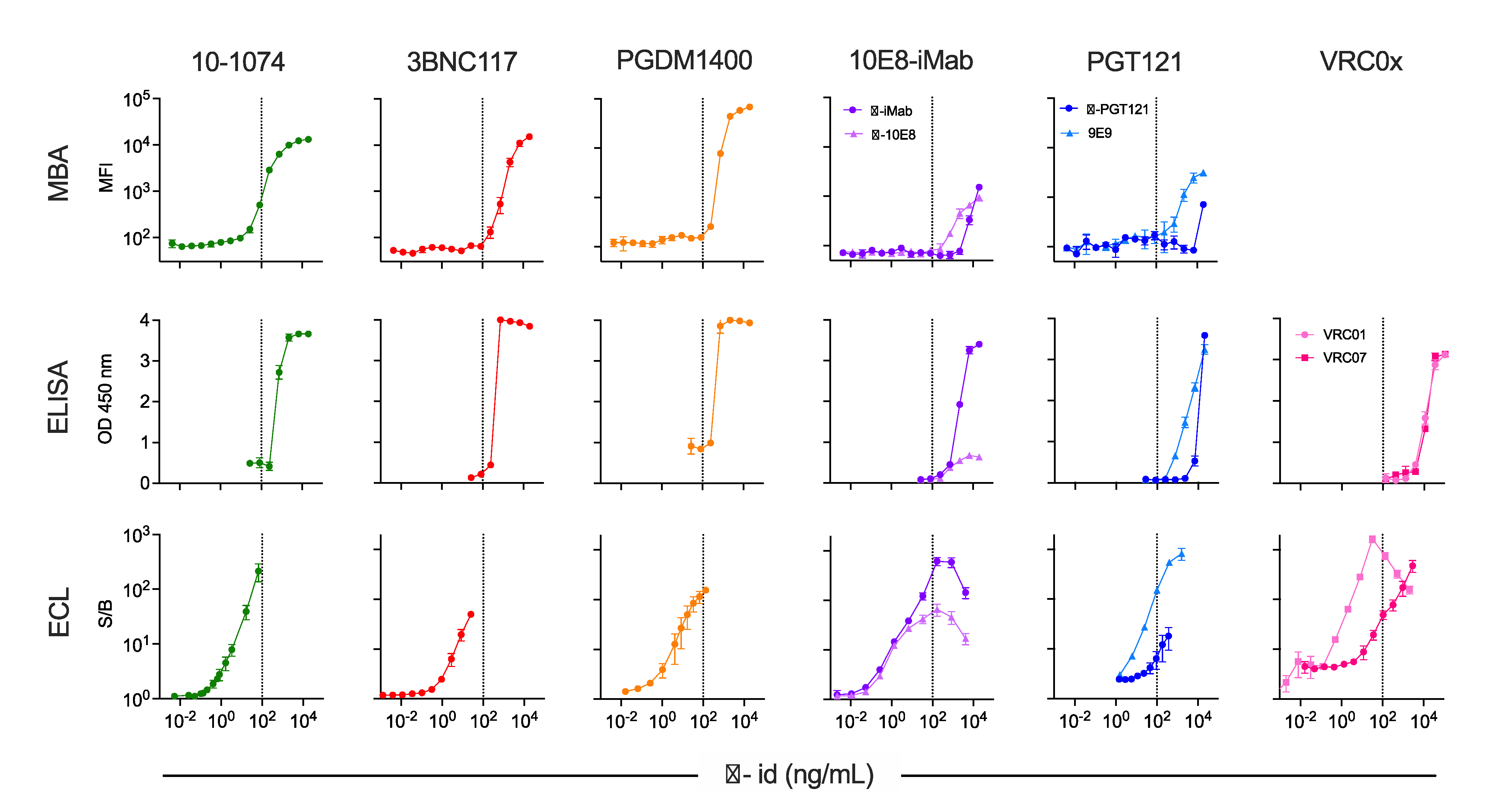
图1 跨试剂和平台的ADA检测结果
垂直虚线表示FDA推荐的100 ng/mL灵敏度,MEI、OD和S/B分别用于MBA、ELISA和ECL检测。
在一种药物有多种抗独特型抗体的情况下,有时会观察到这些不同阳性对照抗体有不同的结合能力。虽然不同平台上识别同一种药物的抗体之间的差异基本一致,但也略有不同。例如,在ECL平台PGT121 ADA检测中,9E9和抗PGT121抗独特型抗体的AS相差三倍,而在MBA平台的检测中则相差九倍。在ELISA和ECL检测中,两种单克隆抗体的灵敏度相似,但峰值信号强度不同。相比之下,在MBA平台桥连检测中,10e8.4-iMab两株抗独特型抗体显示出相似的峰值信号,但抗iMab的AS几乎是抗10E8.4的十倍。
在各种平台中,ECL平台一般都具有最灵敏的ADA检测灵敏度和最大的动态范围。事实上,对于许多药物-抗独特型抗体配对,可能需要对ELISA和MBA方法进行大量优化,以达到建议的100ng/mL检测灵敏度。值得注意的是,在ECL平台中检测0%、25%和50%的集合正常人血清中的抗独特型抗体时,基质浓度对灵敏度的影响相对较小。总之,这些结果表明,不同的检测平台对相同试剂的灵敏度不同,不同的阳性对照对相同的实际实验检测的计算灵敏度也不同。
不同个体之间,甚至同一个体内随着时间的推移,血清中观察到的ADA反应的固有单价亲和力预计会有所不同。同样,抗独特型抗体对其目标药物的亲和力及其支持桥连(三分子)相互作用的倾向与支持二价分子内相互作用的倾向也会存在差异。研究人员检测了抗独特型抗体与相应药物的亲和力,以确定这一属性与ADA检测AS的关系。使用生物层干涉测量法(BLI)测量了二价和蛋白酶酶解的一价形式抗独特型抗体与相应药物的亲和力。药物与抗独特型抗体的二价亲和力介于<10 pM到1 nM之间,而一价亲和力介于1.54 nM到 39.7 nM之间。一价亲和力较高的药物-抗独特型抗体对的二价亲和力也较高(图2B)。虽然分子内和分子间的二价相互作用在BLI检测中无法区分,但在传统抗体中观察到的20-200倍的亲和力差异表明,药物和相应的抗独特型抗体之间的强结合很常见。相对的,双特异性抗体10E8.4-iMab不能实现分子内二价结合,其亲和力是酶解后双特异性抗体亲和力的五倍到八倍。利用这些数据,进一步研究了亲和力与ECL桥连AS测定结果之间的关系,结果发现无论是二价亲和力还是一价亲和力都与AS无关(图2C&D),这表明这一特性对于抗独特型抗体的选择并无帮助,高亲和力的试剂并不一定会导致高计算AS。对结合速率常数(ka)和解离速率常数(kd)与AS之间关系的分析发现,也无显著相关性。
10e8.4-iMab双抗的两种抗独特型抗体间,亲和力和AS的一致性并未被观察到:亲和力弱的抗独特型抗体,ADA检测AS优于亲和力强的(图2E)。相比之下,能识别两种VRCOx药物的5C9抗独特型抗体对VRC01的亲和力和AS均优于对VRC07(图2F)。
总之,虽然亲和力极弱的抗独特型抗体在用作阳性对照时肯定会影响计算出的检测AS,但抗独特型抗体制备过程中获得的亲和力数据可能并不能很好地预测检测敏感性。在确定哪些抗独特型抗体可以在最低浓度下被检测到方面,其他特性(如与药物架连的倾向性)可能同样或更为重要。
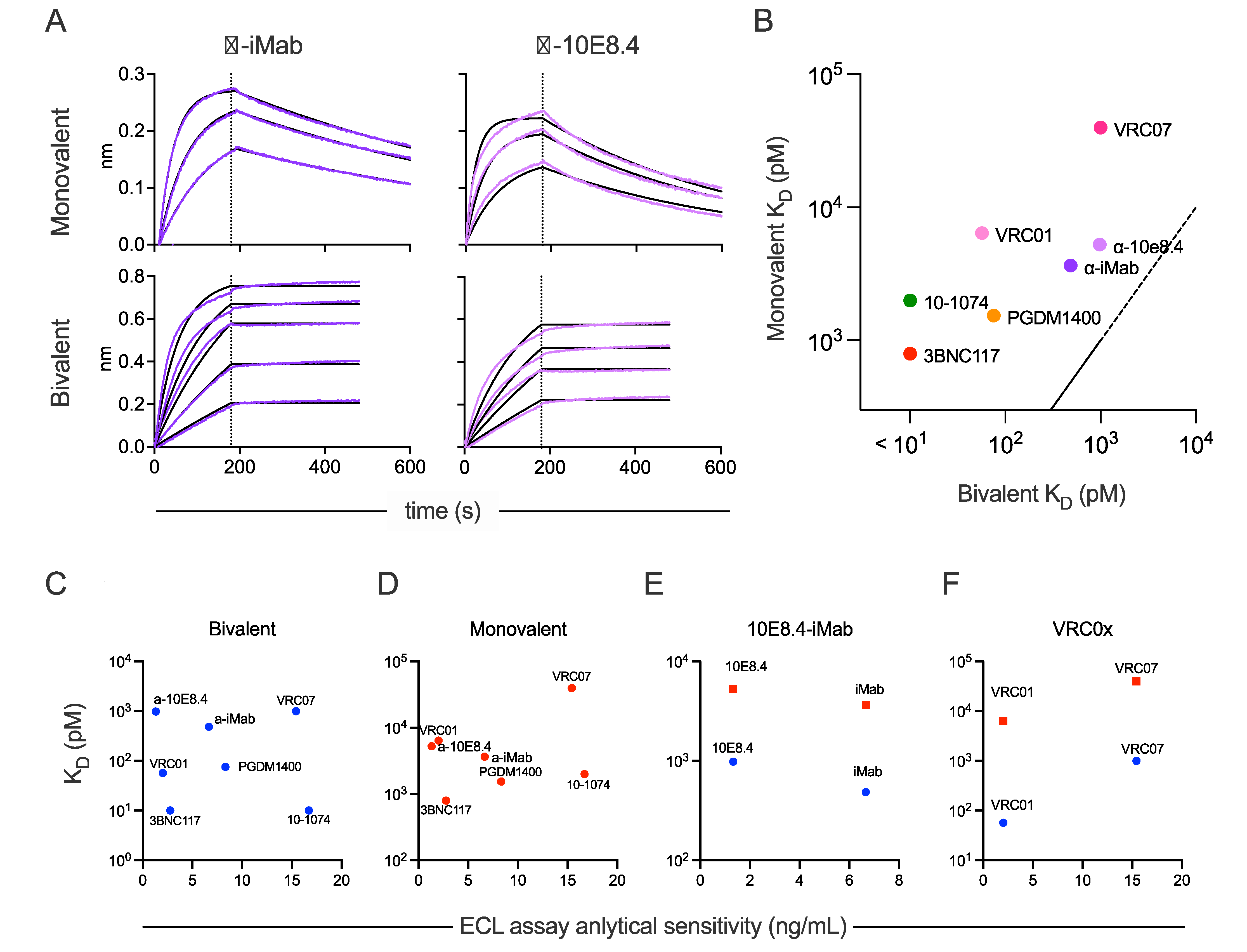
图2 药物-ADA的亲和力与分析敏感性之间的关系
除了在ADA检测中用作阳性对照外,抗独特型抗体对药物PK检测也至关重要,通常根据其在药物检测方面的灵敏性可靠性来选择。为了确定PK检测中选择抗独特型抗体时通常使用的数据是否会影响ADA检测的灵敏度,研究人员在标准筛选检测中对PGDM1400的七种抗独特型抗体进行了评估。在这组试剂中,有两个抗独特型抗体克隆因表现出高度相似的剂量反应曲线而被选中(图3A)。相反,在ECL ADA滴度检测中,这两株克隆的峰值信号相差两个数量级,AS相差一个数量级以上(图3B)。总体而言,在7个阳性对照中,没有观察到与传统ELISA和ECL ADA检测中信号的相关性(图3C)。这些发现共同表明,在抗独特型抗体筛选检测中具有高灵敏度的克隆在桥连法ADA检测中可能并不具有类似的高性能,这也进一步证实了阳性对照抗体选择对计算检测灵敏度的潜在影响。
除了用于确定检测灵敏度外,阳性对照还用于量化检测药物耐受性,并确保检测结果随时间的推移保持一致。研究人员利用PGDM1400的七种抗独特型抗体,研究了阳性对照选择对计算药物耐受性的影响。将单一浓度(400ng/mL)的PGDM1400抗独特型抗体与检测范围内的未标记药物预孵育,并在ECL ADA检测法中评估抗独特型抗体检测结果(图3D)。加入未标记药物会使阳性对照信号随剂量下降,加入250μg/mL未标记药物后,大多数阳性对照信号被完全抑制。计算了每种阳性对照的药物耐受性,并与没有未标记药物存在时的阳性对照信号(图3E)、LOD(图3F)和每种阳性对照的希尔斜率(图3G)进行了比较。剂量反应曲线的差异导致药物耐受性的不同,而药物耐受性与阳性对照的信号幅度、LOD或希尔斜率无关。这一观察结果表明,使用单一抗独特型抗体来定义ADA检测中对循环中存在药物的耐受性可能具有误导性,在解释药物耐受性值时应谨慎。使用多个阳性对照可对检测药物耐受性进行更有意义的评估,但与血清中存在的药物诱导ADA相比,任何阳性对照或一组对照都有可能表现出截然不同的药物耐受性。
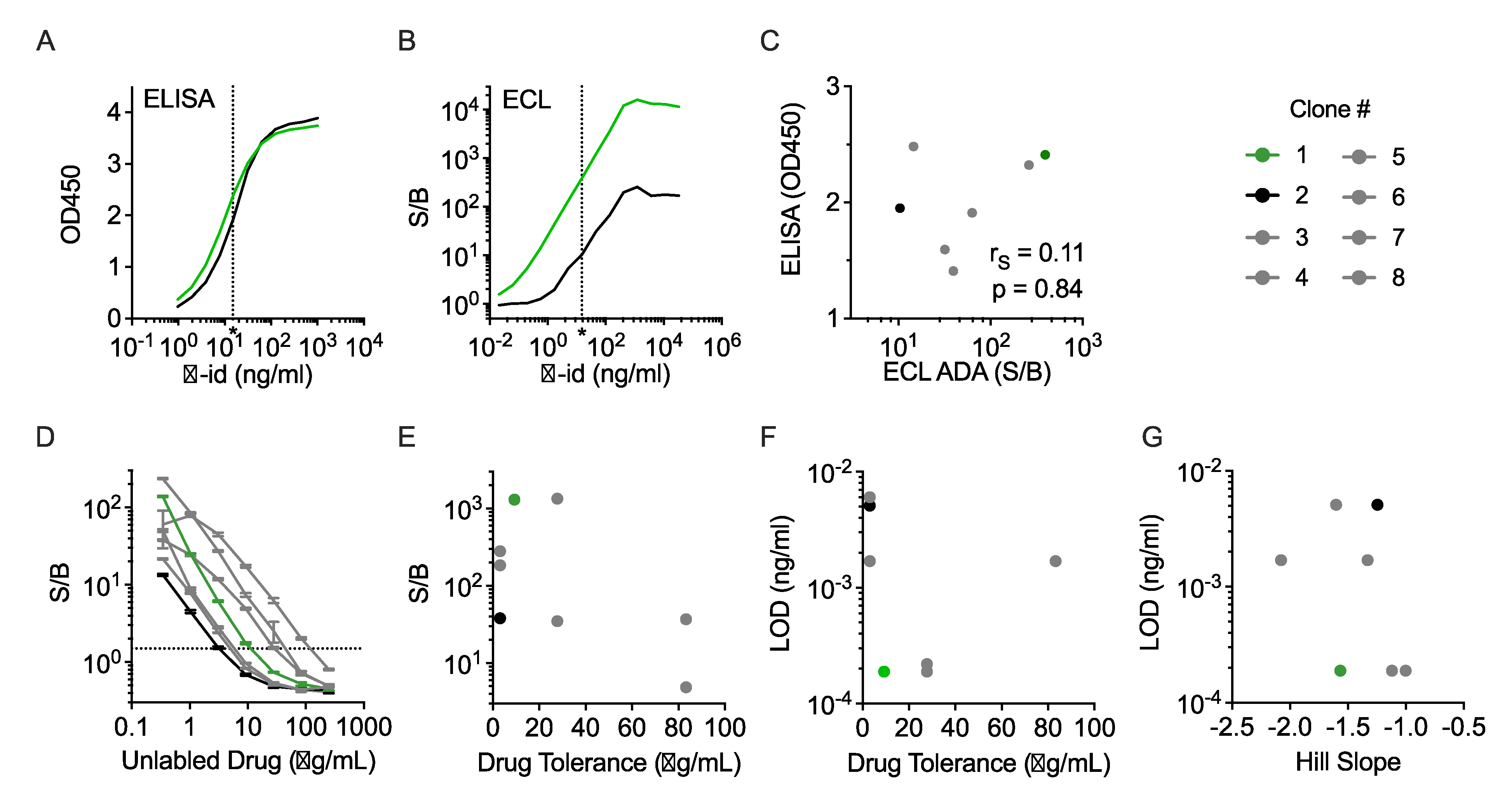
图3 基于ELISA的抗独特型筛选与ADA检测结果的比较
由于在同一实际检测中依赖不同的抗独特型抗体导致计算出的AS存在差异,研究人员试图研究Fc结构域更保守的性质是否可以作为通用手段检测ADA灵敏度。可用于不同药物的阳性对照可作为检测灵敏度的通用衡量标准。在ECL ADA检测中评估了一组不同的多克隆和单克隆抗IgG二抗试剂,它们对抗体不同结构域具有特异性,且识别不同物种抗体Fc(图4A)。
相比抗独特型抗体在上述7种治疗性抗体中显示出较大的剂量反应分布,抗IgG多克隆抗体则更一致地显示出相对统一的结合模式。其余的差异可能来源于药物之间存在细微差异,或是化学标记和偶联制备过程中产生的差异。
而抗IgG单克隆抗体试剂显示出巨大的差异:识别位点在铰链区的试剂对部分药物基本没有观察到药物桥接,这表明单克隆抗体可能对药物之间的微小差异更敏感,只要这些差异属于它们识别的特定表位范围内。这些数据表明,可能没有真正通用的标准阳性对照,但对于治疗性抗体,仍有方法支持使用药物桥接ADA检测之间的基本比较。
最后,研究人员探究了阳性对照在确保检测性能一致性方面的作用。导致性能变化的最常见因素是药物偶联物的不稳定性,阳性对照的不稳定性对检测性能的影响并不常见。通过对两批VRC01药物偶联物进行了比较,这两批药物偶联物在制备时间上有所不同,但都使用了抗独特型抗体和多克隆山羊抗IgG试剂进行检测(图4B)。这两种阳性对照对药物偶联物随着制备时间的变化明显表现出不同的AS。同样,用浓度在线性范围内的七种抗独特型抗体和一种抗IgG阳性对照对新鲜制备和老化的PGDM1400药物偶联物进行了测试(图4C),老化药物偶联物在所有阳性对照中的检测信号都有所下降。然而,对于不同药物,药物偶联物制备时间的影响可能不尽相同,存在某些情况下AS没有变化,而另一些情况下信号完全消失(图4D)。这些观察结果表明,使用多组阳性对照抗体有助于识别药物偶联物中更微妙的变化。

图4 作为阳性对照替代品的非抗独特型抗体性能评估
比较三种不同平台的ADA桥接检测方法,包括ELISA、MBA和ECL,其中ECL的灵敏度最高。使用不同检测方法抗独特型抗体检测特征的差异导致了临床样本的ADA反应阳性率也会经常出现差异。随着更一致地使用桥接检测方法,可能会产生更有意义的比较分析。
评估ADA反应检测灵敏度缺乏统一标准,只能依赖性能各异的阳性对照来满足监管指南的要求。可用的阳性对照性能越差,计算出的检测灵敏度可能就越低,而如果因此必须检测浓缩血清,检测灵敏度实际上可能就越高。
对于抗独特型抗体亲和力属性和直接法ELISA检测AS预测桥接ADA检测AS和药物耐受性的能力,由于抗独特型抗体选择通常是根据药代动力学试验中使用的直接结合试验的灵敏度来进行的,因此很可能会导致ADA桥接试验灵敏度和药物耐受性不达标。同样阳性对照对药物偶联物的变化具有不同的敏感性,这可能会影响临床样本中ADA反应检测的可靠性。综上说明了在解释ADA检测结果时需要注意的事项,以及在检测开发和监测过程中纳入多个阳性对照的价值。
关于ADA检测阳性对照的进一步的建议:
1.用一组包含多个表位的不同阳性对照来定义灵敏度和药物耐受性,有助于建立更具代表性的检测特性,并确保检测结果的长期一致性。
2.在早期抗独特型抗体开发的过程中,同时考虑PK检测和ADA检测的应用,而不是在选定单个克隆后再进行ADA检测开发,这样可确保最适合PK检测但不适合ADA检测的抗独特型抗体不被优先考虑。
遗憾的是,目前似乎还没有实证检验的替代方法可以显示阳性对照敏感性、药物耐受性和识别试剂损伤的能力。不过,随着ADA检测越来越标准化,会进一步思考这些参数和优化选择对临床的影响,以支持对ADA检测数据进行最具临床相关性和影响力的解释。
参考文献
Weiner JA, Natarajan H, McIntosh CJ, et al. Selection of positive controls and their impact on anti-drug antibody assay performance. J Immunol Methods. 2024 May;528:113657.

澳门威斯人游戏平台[亚洲]全站最新版V11.37.7 Nanjing Detai Bioengineering Co.,Ltd. ©2024 All Rights Reserved