![澳门威斯人游戏平台[亚洲]全站最新版V11.37.7](/wp-content/themes/2023/images/banner/technical-resources.jpg?v=18)
蛋白质相互作用的研究是阐释基因功能的重要手段,近年来发展起来的高分辨率质谱技术为蛋白质复合体的鉴定提供了强有力的工具,因此确定蛋白质间相互作用的限制因素不是蛋白质鉴定,而是蛋白质复合体的纯化。传统的纯化方法(如亲和层析或免疫共沉淀)难以得到接近天然状态的蛋白复合体,且实验结果可能存在假阳性。
串联亲和纯化(tandem affinity purification,TAP)是一种能快速研究体内蛋白相互作用的技术,经过两步特异性亲和纯化,可快速得到生理条件下与靶蛋白质存在真实相互作用的蛋白质。TAP方法最初用于酵母中,因其具有通用性、高效性、高纯度及假阳性低等特点得到了快速发展,至今已成功运用于许多其他生物(哺乳动物、植物等)相互作用的研究。
强大、灵敏度高的高通量质谱(MS) 技术的出现,可以在飞摩尔(fm)以下的范围检测肽分子,常用来鉴定相互作用的蛋白质复合体或复合体亚基,大大促进了细胞蛋白质组的生物化学纯化方法的发展。但通常难以获得足够量纯化的蛋白质复合体,成为质谱在这方面应用的一个限速步骤。1999年Rigaut 等共同提出了一套分离复合蛋白的新方法–串联亲和纯化(Tandem affinity purification,TAP), 兼具标准亲和纯化和免疫共沉淀两种生化方法的优点,为蛋白质复合体的分离鉴定提供了一条新途径,串联亲和纯化联合蛋白质质谱(MS) 鉴定技术可以进行生物化学纯化,双分子和大分子蛋白质复合体的分析
利用串联亲和纯化检测蛋白质间相互作用的原理是在靶蛋白质一端嵌入一个特殊的蛋白标签(TAP tag),不破坏靶蛋白质调控序列。将构建好的靶蛋白质粒转入靶细胞内进行表达,如果靶细胞内存在相互作用蛋白,则会与靶蛋白结合形成蛋白复合物。利用TAP标签进行两步连续的亲和纯化获得接近天然条件的靶蛋白复合物。随后用质谱等技术对靶蛋白复合物进行鉴定,从而达到研究蛋白质间相互作用的目的。
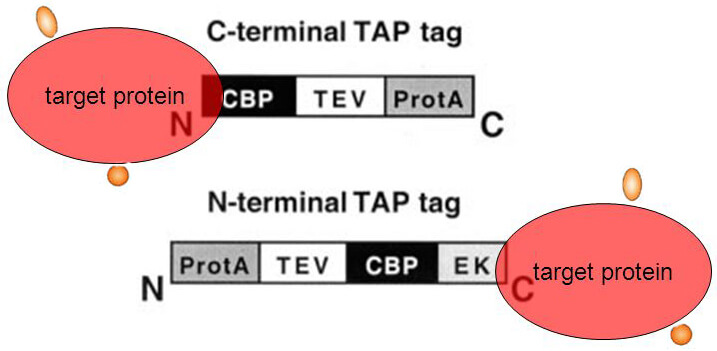
最初设计的TAP标签主要由金黄色葡萄球菌蛋白A的两个IgG结合域(ProtA)和一个钙调蛋白结合肽(calmodulin-binding peptide,CBP))构成,中间被一个TEV蛋白酶的酶切位点隔开(见右图)。
用IgG亲和柱进行亲和纯化,ProtA与亲和柱紧密结合,洗去未结合的杂蛋白。再用TEV蛋白酶酶切,获得CBP-融合蛋白。
将酶切后获得的CBP-融合蛋白与偶联有钙调蛋白的亲和柱混合进行第二轮亲和纯化。在钙离子存在下,CBP就会与钙调蛋白紧密结合,用含有EGTA的洗脱液进行温和洗脱,即可得到高纯度的靶蛋白(如果靶细胞内存在相互作用蛋白,则获会得靶蛋白复合物)。
两轮的亲和纯化顺序为先利用IgG亲和柱进行纯化,再利用钙调蛋白偶联亲和柱进行纯化。如果纯化的顺序互换,可能存在TEV酶污染的问题。
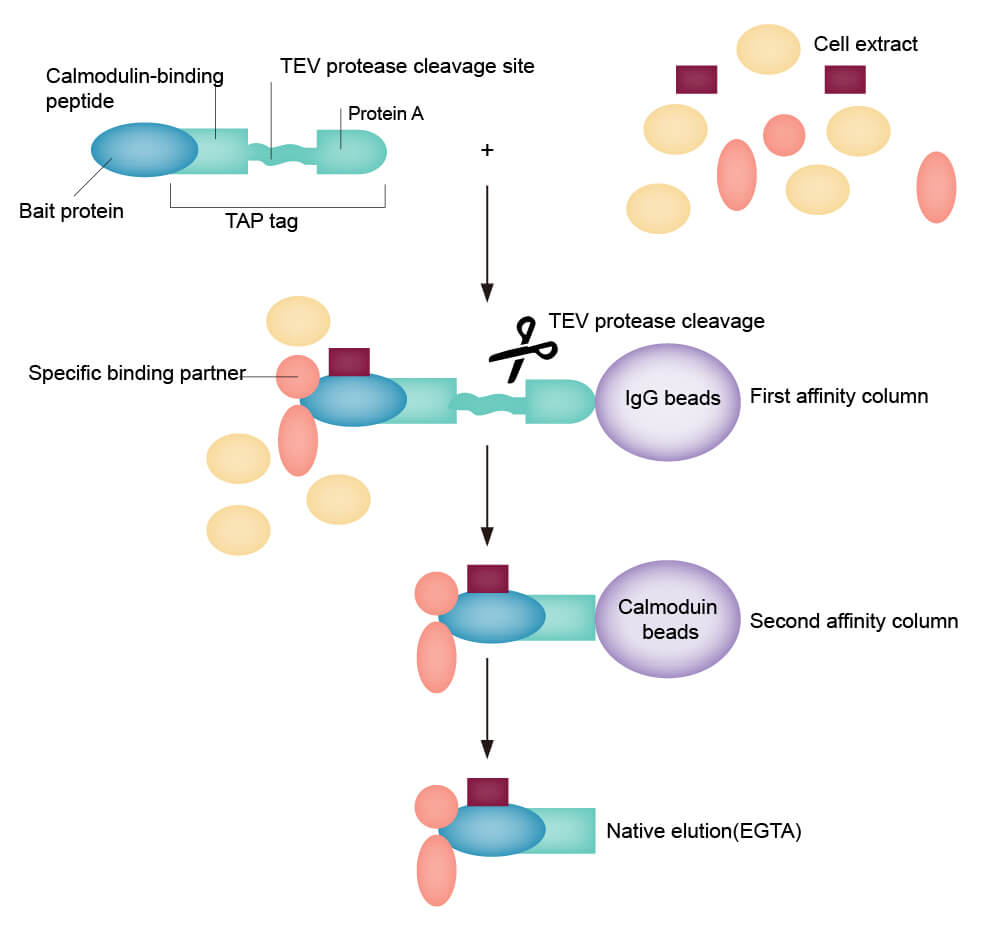
图2:串联亲和纯化(TAP)原理
构建TAP标签-蛋白质粒导入到细胞或生物体内。获得可正常表达的融合TAP标签蛋白。
转染后,获得细胞抽提物。需要注意的是:各无论何种抽提策略,都必须保证能够降低非特异性相互作用的干扰,同时尽可能不要破坏自然存在的相互作用。
随着TAP技术的发展,越来越多的标签供不同串联组合,常见的TAP标签有FLAG 标签、金黄色葡萄球菌蛋白 A 的 2个 IgG 结合域(ProtA)、Strep 标签、His 标签、钙调蛋白结合肽(calmodulin2binding peptide,CBP) 以及角质素结合结构域(chitin2binding domain,CBD)等。在选择串联标签时应综合考虑纯化回收率、纯度、对融合蛋白的结构和生物学的影响以及成本等因素。
在两亲和纯化标签之间存在酶切位点,该位点以烟草蚀纹病毒酶切点(TEV)最为常见,原因是TEV蛋白酶高效特异,基本不含其它细胞蛋白识别点,使用TEV蛋白酶切掉相关蛋白质的概率极低。
标签融合的位置: 融合标签可以加在靶蛋白的N端也可以加在靶蛋白的C端,通常推荐使用C-端TAP标签,这样可以使融合蛋白的表达在天然启动子的控制下,蛋白表达不受影响(有的蛋白当其C端加上其它肽段后会影响该蛋白的功能,此时应利用N端TAP标签)。如果不知如何选择标签,可以在实验初始设计两条融合蛋白(标签位置一条在N端,一条在C端),以应对无法顺利表达的问题。
酵母双杂交系统检测蛋白相互作用
免疫荧光共振检测蛋白相互作用

澳门威斯人游戏平台[亚洲]全站最新版V11.37.7 Nanjing Detai Bioengineering Co.,Ltd. ©2024 All Rights Reserved
苏ICP备2021019379号-1 | 网站地图 | 用户协议 | 隐私政策