![澳门威斯人游戏平台[亚洲]全站最新版V11.37.7](/wp-content/themes/2023/images/banner/technical-resources.jpg?v=18)
免疫球蛋白A(IgA)是黏膜免疫系统中最主要的抗体成分,也是人体每天产生最多的抗体。与其他免疫球蛋白相比,IgA在分子形式、糖基化模式以及存在1个以上的受体等方面具有独特的性质。
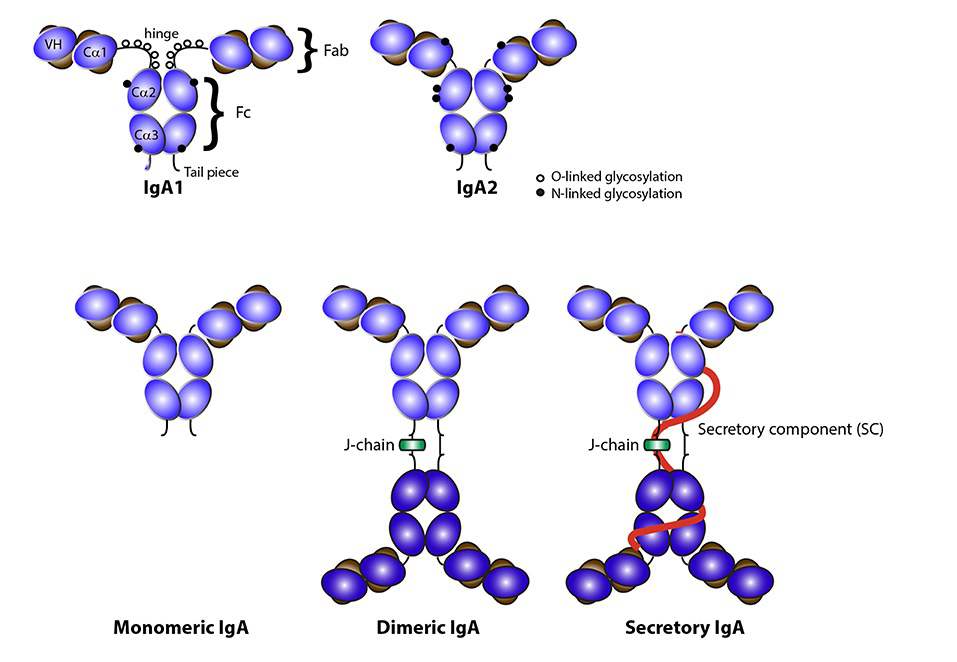
在人体中,IgA单体以两个密切相关的亚型存在,即IgA1和IgA2,区别在于IgA1分子铰链区中多13个额外的氨基酸。这种延伸的铰链区有利于较远距离抗原的识别。两个IgA亚型在其CH1和CH2结构域中都存在高度N-糖基化,糖类约占其含量的6%。IgA1在铰链区含有额外的O-连接聚糖,由N-乙酰半乳糖胺与半乳糖和唾液酸组成。值得注意的是,IgA1铰链区的聚糖组成是异质性的,据报道异常糖基化与IgA肾病的发病机制有关。
IgA主要以三种不同的形式存在。在人体血清中以单体形式存在,而在粘膜部位,它以聚体的形式存在(pIgA),可分为二聚体IgA(dIgA)和分泌型IgA(sIgA)。
除少数例外,几乎所有治疗用的抗体均为IgG类,这可以归因于该抗体类别在人体内的天然丰度,长半衰期,但也归因于对IgG的全面了解和对其他同种型了解有限。
IgA作为治疗性抗体主要具有以下优势:与其他免疫球蛋白同种型相比,IgA可以与多种受体相互作用,包括多聚免疫球蛋白受体(pIgR)、转铁蛋白受体(CD71)、脱唾液酸糖蛋白受体(ASGPR)、dectin-1、DC-SIGN和FcαRⅠ(CD89)等,能更有效地激活细胞效应功能。以癌症研究背景为例,IgA可以通过FcαRⅠ诱导比IgG更强的中性粒细胞介导的肿瘤细胞杀伤力,相比之下IgG缺乏中性粒细胞的有效活化。这可能是由于IgA介导的LTB4释放导致中性粒细胞迁移增强。此外,IgA通过ADCC、氧化爆发(oxidative burst)、细胞因子和中性粒细胞的NETs释放诱导更强的吞噬作用。尽管FcαRⅠ表达低于FcγR,但IgA-FcαRⅠ结合诱导比IgG-FcγR结合更强的ITAM信号传导。
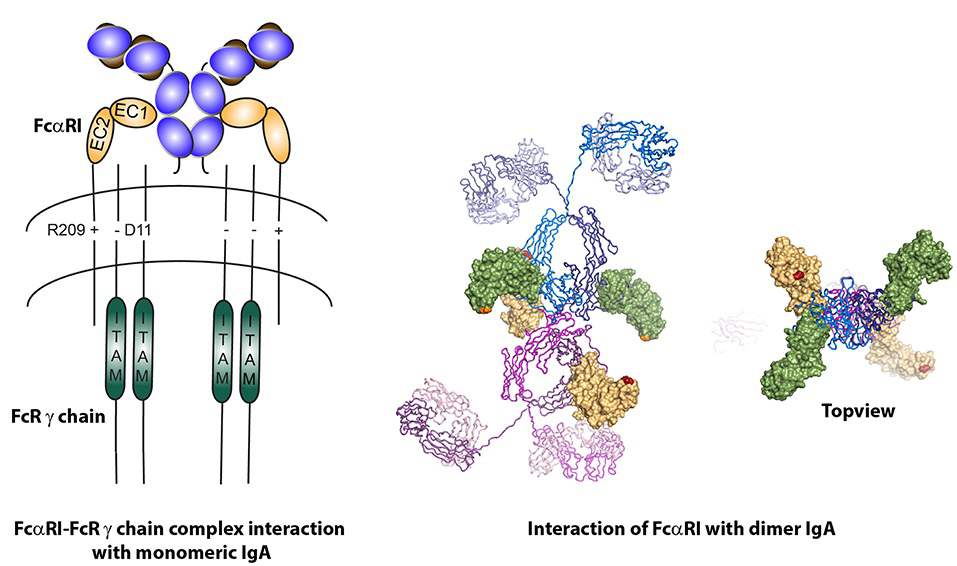
与IgG相比,IgA除了通过FcαRⅠ ITAM信号通路介导更强的免疫激活外,IgA还可以通过抑制性ITAMi途径介导更强的免疫调节作用。这些免疫调节特性在治疗炎症性疾病中具有很大的治疗潜力。
IgA的研究和临床使用可能由于以下几个原因受到阻碍:(1)小动物模型的问题,尤其是啮齿动物。啮齿动物与人类IgA有很大不同,小鼠和大鼠B细胞仅产生一个亚型的IgA,且其在血清中是以二聚体形式存在。存在两个亚型IgA这一特征仅与黑猩猩、大猩猩和长臂猿共享。主要的IgA受体FcαRⅠ在啮齿动物中缺失,并且人IgA在小鼠中只有很短的半衰期。(2)重组生产IgA的问题。由于IgA存在高度和异质的糖基化,生产过程中可能引起糖基化类型的改变,增强免疫原性和清除率。(3)与IgG相比,IgA半衰期短,需要较短的给药间隔。
多年来,sIgA一直被认为是对抗粘膜表面病原体的第一道屏障。sIgA能凝集细菌,干扰细菌运动,中和细菌毒素,还能抑制细菌对上皮的粘附,从而防止病原体向循环传播。已经证实IgA可对抗多种胃肠道病原体,例如鼠伤寒沙门氏菌,福氏志贺氏菌,艰难梭菌以及某些病毒。特别是,IgA对仙台病毒、人类免疫缺陷病毒和流感病毒具有中和作用。最近研究表明,IgA在中和SARS-CoV-2方面比IgG更有效。IgA还可以通过与FcαRⅠ的相互作用介导对微生物感染的保护。已经证明,在人FcαRⅠ转基因小鼠中输注抗原特异性IgA可以导致结核分枝杆菌或百日咳博德特氏菌的清除率增强。基于这些观察结果,被动转移特异性IgA和主动免疫可能是对抗病毒和细菌感染的有效策略。
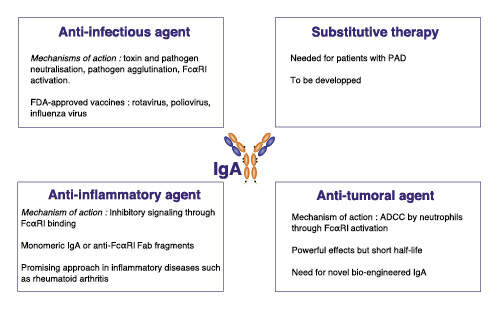
IgA的治疗潜力
轮状病毒疫苗被视为了解肠道IgA在胃肠道病毒感染中的治疗潜力的模型系统。在该疫苗开发前后,几项相关研究表明,轮状病毒特异性IgA是赋予人类和动物模型长期免疫力的主要效应分子之一。目前的两种口服疫苗Rotarix®(葛兰素史克生物制品)和RotaTeq®(默克)于2006年获准使用。接种两剂疫苗后,血清抗轮状病毒IgA阳转率约为95%,可通过血清IgA滴度预测保护持续时间和疫苗效力。
原发性免疫球蛋白缺乏症(PAD)患者的免疫球蛋白水平降低,易发生感染。使用IgG替代疗法成功地降低了严重细菌感染的频率。然而,非呼吸道和上呼吸道感染持续存在,尤其是IgA和IgM水平低的患者。一项研究报告证实,使用Pentaglobin®(一种含IgA和IgM的制剂)成功治疗PAD患者的空肠弯曲菌复发性感染。与Pentaglobin®相比,Trimodulin(BT-588)的IgA含量其两倍,可限制重度社区获得性肺炎患者的继发感染。
值得注意的是,没有关于选择性IgA缺乏症治疗的报道(选择性IgA缺乏症是最常见的PAD)。这可能是由于对Ig产品的反应和抗IgA抗体的出现。过往曾出现缺乏IgA的患者由于输注IgG(含有少量IgA)而出现抗IgA抗体,导致全身性过敏反应。但也有综述详细描述了抗IgA抗体的产生与过敏反应的发生并不相关。未来,需要大型研究来评估含有IgA的产品在预防感染方面的安全性和治疗效果,特别是在选择性IgA缺乏症的治疗中。
用于治疗各种癌症的治疗性抗体通过直接和间接效应功能的组合来消除肿瘤细胞,包括补体依赖性细胞毒性(CDC)、抗体依赖性细胞吞噬作用(ADCP)和抗体依赖细胞介导的细胞毒作用(ADCC)。虽然IgG抗体在治疗领域占主导地位,但应该注意的是,IgA通过表达FcαRⅠ的巨噬细胞和中性粒细胞的活性也可以有效杀死肿瘤细胞。在这方面,体外实验结果表明,与IgG相比,IgA在中性粒细胞触发ADCC方面更胜一筹。随着FcαRⅠ转基因小鼠的产生,体内实验模型得到了极大的改善。在各种实体瘤模型中,已经证明抗EGFR IgA2抗体具有有效的抗肿瘤活性。在小鼠淋巴瘤模型中,抗CD20 IgA2在中性粒细胞募集到肿瘤部位后引起强大的抗肿瘤作用。
IgA抗体的半衰期很短,到目前为止阻碍了它们作为治疗性抗体的使用。最近的糖工程策略显著改善了重组IgA的药代动力学特性。例如,与野生型IgA相比,唾液酸化增加和聚糖末端半乳糖残基缺失的IgA分子表现出更长的血清半衰期,为免疫治疗提供了一种有希望的形式。另一种策略通过与可以结合白蛋白的结构域融合来增加IgA的半衰期。在人体中,可延长其血清半衰期至19天。除药代动力学外,IgA和CD47-SIRPα阻断剂的联用也提供了证据,表明靶向吞噬检查点抑制剂可增强IgA功能,这与IgG一致。
IgA与FcαRⅠ结合传播抑制信号,导致抗炎反应。因此,靶向FcαRⅠ可能是治疗各种炎症性疾病的一种有希望的策略。事实上,发现向FcαRⅠ转基因小鼠施用mIgA可预防和解决实验诱导的关节炎。同样,在类风湿关节炎患者中,mIgA能够在体外抑制促炎细胞因子的产生和骨髓细胞的趋化性。抗FcαRⅠ Fab片段可以驱动ITAMi诱导的抑制信号传导,并已在肾脏炎症模型中证明了其治疗潜力。还有研究表明,用抗FcαRⅠ预处理FcαRⅠ转基因小鼠可大大减少支气管炎症的发展。综上所述,FcαRⅠ靶向可能是预防或治疗炎症性疾病的一种新的有前途的工具。
在IgA半衰期和生产方面的研究进展为进一步拓展商业规模IgA生产提供了有意义的改善。由于IgA是对抗粘膜表面病原体的主要抗体,最近的研究还针对口服IgA进行了开发。全长sIgA或嵌合IgA已经被添加到食品中,用于在体外中和细菌毒素或预防胃肠道感染。未来的工作还应集中在简化制造工艺,降低生产成本上,也可汇集IgA和IgG同种型的优势,考虑将交叉同种型分子或双特异性抗体的工程设计用于治疗应用。
参考文献
[1]Sterlin D, Gorochov G. When Therapeutic IgA Antibodies Might Come of Age. Pharmacology. 2021;106(1-2):9-19. doi: 10.1159/000510251.
[2]Bohländer F. A new hope? Possibilities of therapeutic IgA antibodies in the treatment of inflammatory lung diseases. Front Immunol. 2023 Mar 27;14:1127339. doi: 10.3389/fimmu.2023.1127339.
[3]Breedveld A, van Egmond M. IgA and FcαRⅠ: Pathological Roles and Therapeutic Opportunities. Front Immunol. 2019 Mar 22;10:553. doi: 10.3389/fimmu.2019.00553.

澳门威斯人游戏平台[亚洲]全站最新版V11.37.7 Nanjing Detai Bioengineering Co.,Ltd. ©2024 All Rights Reserved
苏ICP备2021019379号-1 | 网站地图 | 用户协议 | 隐私政策