![澳门威斯人游戏平台[亚洲]全站最新版V11.37.7](/wp-content/themes/2023/images/banner/technical-resources.jpg?v=18)
Far-western blot是一种检测蛋白间相互作用的分子生物学方法。它可以验证已知蛋白间的相互作用,或分析已知蛋白和未知蛋白间的相互作用。Far-Western blot技术与Western blot相似。在Western blot实验中,用特异性抗体(一抗)去检测膜上的蛋白,HRP标记的二抗与一抗结合,通过显影观察膜上的蛋白。而在Far western blot中,将靶蛋白固定在PVDF/NC膜上,用诱饵蛋白(已知蛋白)作为探针去检测膜上的靶蛋白,再利用特异性抗体孵育、检测,以此来分析靶蛋白和诱饵蛋白间的相互作用。
Far-western blot实验流程主要包括:①凝胶电泳;②转膜;③封闭;⑥孵育;⑦检测。下面对Far-western blot的实验操作流程做系统介绍。
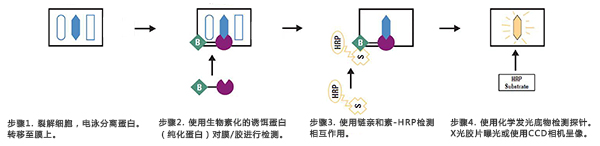
通过凝胶电泳将样品中不同大小的蛋白分离开来。电泳可以用十二烷基硫酸钠 – 聚丙烯酰胺凝胶电泳SDS-PAGE或天然PAGE分离。
样品中的蛋白在凝胶上分离后,将蛋白质从凝胶转移到膜上。此步骤的目的为将蛋白附着到膜的表面,使蛋白变得易于探测。在转膜的过程中需小心操作,避免污染问题。如果转膜过程存在污染,则最终检测结果会出现很高的背景。
转膜结束后一般采用异源性蛋白质封闭整张膜,以阻塞非特异性结合位点。常用的封闭剂有脱脂奶粉、BSA等。需要说明的是,封闭剂有可能会发生交叉反应或者以其它的方式破坏待研究的蛋白相互作用,需要根据经验确定合适的封闭剂。
将诱饵蛋白与封闭后的膜共孵育,使诱饵蛋白与NC膜上相互作用的蛋白结合,孵育后洗去未结合的诱饵蛋白。探针蛋白通常可以利用大肠杆菌表达系统生产出来,虽然细胞裂解液也可以作为探针蛋白,但是为了降低实验背景,最好选择纯化的蛋白作为探针(诱饵蛋白的纯度越高,实验的成功率就越高)。
检测探针蛋白的策略通常有以下几种:
为了提高结果的准确性,需要设置合适的实验对照。例如,如果诱饵蛋白为GST-融合蛋白,则单独设置一组GST标签实验组作为阴性对照,排除GST标签本身与膜上的靶蛋白存在非特异性结合的可能性。
| 对比项目 | Far-western blot | Western blot |
|---|---|---|
| 凝胶电泳 | 天然(通常)或变性 | 天然或变性(通常) |
| 转膜 | PVDF膜/NC膜 | PVDF膜/NC膜 |
| 封闭 | 脱脂奶粉/BSA | 脱脂奶粉/BSA |
| 检测策略 |
|
一抗→酶标二抗 |
| 实验对照 | 需要 | 不需要 |
注意事项:
检测标记时,通常用酶(辣根过氧化物酶或碱性磷酸酶)标记抗体。相比之下,诱饵蛋白不选用酶标记,因为大的酶标记可能在空间上阻碍诱饵和靶蛋白之间结合。

澳门威斯人游戏平台[亚洲]全站最新版V11.37.7 Nanjing Detai Bioengineering Co.,Ltd. ©2024 All Rights Reserved
苏ICP备2021019379号-1 | 网站地图 | 用户协议 | 隐私政策