![澳门威斯人游戏平台[亚洲]全站最新版V11.37.7](/wp-content/themes/2023/images/banner/technical-resources.jpg?v=18)
大肠杆菌根据表达部位的不同可将蛋白表达的形式分为3种:第1种为胞外分泌,即目的蛋白被分泌到培养基中。这种方式表达的蛋白容易纯化,不易降解,但通常只有少量的蛋白质可以分泌到细胞外;第2种为周质空间表达,这种方式表达的蛋白存在于周质间隙中,外周质的氧化环境有利于蛋白质的正确折叠,在向外周质转移的过程中,信号肽在细胞内剪切,更有可能产生目的蛋白的天然N末端;第3种为胞内表达,这种表达易形成无活性的包涵体,需要经过繁琐的变性、复性过程才能得到有活性的蛋白。
因为多数蛋白不能够进行分泌表达,且表达量较少,所以分泌蛋白表达方法很少被使用;现阶段实验科研中常用的方法是融合型蛋白表达,包括蛋白上清表达和包涵体复性,以上俩种方法均可获得大量的可溶性蛋白。有关通过蛋白复性获得可溶性蛋白请参见《包涵体蛋白复性的方法操作》,这里主要从条件优化的角度讨论第一种方法。
可溶性蛋白的产率取决于蛋白的合成速率,蛋白的折叠速率,以及聚集的速率。高水平表达时,肽链聚集的速率一旦超过折叠速率,就会形成包涵体。因此,降低重组蛋白合成的速率有利于提高重组蛋白的可溶性表达。常用的方法有培养温度的优化、挑选合适的启动子、诱导剂和诱导条件的优化等。
密码子的使用对外源基因的表达水平有重要的影响。密码子优化就是根据表达系统对密码子的偏好性进行优化筛选。经过优化的基因序列往往能提高mRNA二级结构的稳定性,有利于新生肽段的正确折叠,提高外源活性蛋白的表达。值得注意的是,稀有密码子存在通常会对蛋白表达产生负面影响,在转录过程中稀有密码子的位置以及转录的速率都会影响密码子的翻译,但在某些基因中使用稀有密码子则能显著降低肽链的延伸速率。
启动子的选择需要从启动子强度、漏表达程度、诱导性及经济因素等方面考虑。在胞内表达中,常采用T7、PL等强启动子,表达水平可达菌体总蛋白的70%。若重组蛋白多以包涵体形式存在,可采用强度较弱的lac等启动子以达到一个与表达能力相匹配的翻译速率。(资料查看:基因表达密码子优化)
大肠杆菌的最适生长温度在37~39℃之间,但此温度下极易生成包涵体蛋白,降低可溶性蛋白的表达,而低温培养条件下表达外源蛋白能有效地增加可溶蛋白的比例。

由表可知:不同的外源蛋白低温表达时,可溶性蛋白的表达水平有明显提高。但培养温度有一定下限(8~10℃),在此温度以下,蛋白基本上停止表达。降低培养温度有利于重组蛋白合成速率的降低,因为蛋白质的合成较慢,新合成的蛋白质会有更充分的时间折叠,增加蛋白的正确折叠率的同时降低重组蛋白的降解速率。
培养基的组成对可溶外源蛋白的表达有显著影响。一般情况下,蛋白表达采用合成培养基,但合成培养基往往又存在菌体生长较慢和菌体浓度较低的问题。外源蛋白的表达显著地受葡萄糖浓度的影响,在诱导表达时期,需尽量保持低水平的葡萄糖,可以用甘油代替葡萄糖作为表达外源蛋白的碳源是解除葡萄糖效应的有效途径之一。在诱导时期,流加营养物质也有可能显著提高可溶蛋白表达。考虑以下几点也可以提高可溶性蛋白的表达量:
诱导时间和诱导剂的用量也是控制可溶性外源蛋白表达的重要因素。
诱导剂种类及其浓度都会对外源蛋白表达产生重要影响,应根据所采用的表达系统(比如启动子的强弱)和外源蛋白的特点优化选择。摇瓶培养时,应选用低菌体浓度诱导,因为在低菌浓度下菌体处于对数生长期,生长活跃,有利于表达可溶性蛋白。然而,如果能保证合理的补料与充分的通气,在较高菌浓度下诱导也同样可能获得可溶蛋白的高效表达。在某些情况下,诱导剂的流加能显著提高可溶蛋白的表达水平。
分子伴侣的功能主要是通过阻止或校正不合理的疏水结合来帮助肽链形成正确的三维结构。
大肠杆菌的分子伴侣是由2个类型的蛋白质构成的,分别是Hsp60蛋白和Hsp10蛋白,二者都包含疏水区域,这些区域可与未折叠或错误折叠的多肽链结合,经过一个依赖ATP的过程帮助蛋白正确折叠。将几种分子伴侣同时表达,有可能获得比单独使用更好的效果。需要注意的是,共表达分子伴侣应根据重组蛋白自身的特点进行选择。还有一个需要考虑的是培养温度,温度可能会对共表达分子伴侣的效果产生重要的影响。
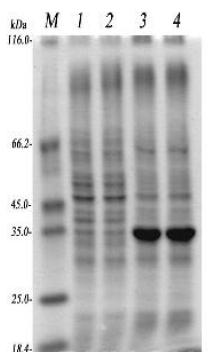
1:pET-32aA3未诱导,2:pET-32aA3未诱导,3:pET-32aA3诱导后,4:pET-32aA3诱导后
由图可知,目的蛋白经IPTG诱导后明显表达,分子量约为35kd。
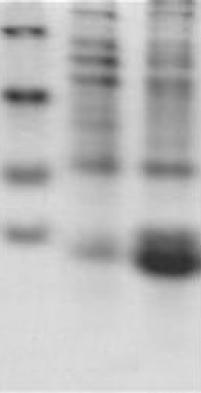
1: pET-32aA3 诱导上清,2: pET-32aA3 诱导沉淀
由上图可知,目标蛋白在上清也有表达,即存在可溶性的表达,但是量很少,大部分也包涵体的形式存在(沉淀中),而包涵体的存在也证明了蛋白表达量很高,上清可溶蛋白的可操作性等因素都优于对包涵体蛋白的分离纯化,所以可通过探索可溶表达条件,最终来加大上清蛋白的含量,以利于下一步实验的进行。
影响包涵体形成的因素有很多,如诱导温度,诱导时间,IPTG诱导表达浓度,摇床转速等等,所以设定在低IPTG浓度下(0.1 mmol/L),在不同温度,诱导时间下的表达对照:
过程:挑取一单菌落接种于含氨苄(Amp,终浓度为100g/mL)的3mL 液体LB 培养基中37℃,250rpm 培养过夜。将过夜培养菌液以1:100 转接于含上述抗生素的50mL+50mL+60mL 液体LB 中,37℃,250rpm,3.5h(大量培养至OD600=0.6 左右)。从60mL 培养液中取10mL作为未诱导对照,标记3 个50mL LB 培养菌液:
都分5次取样:
诱导培养结束后,将上述样品分别破菌离心,得上清与沉淀,加2× 上样缓冲液,沸水浴10min,SDS-PAGE 检测。
SDS-PAGE 检测:
例:23℃条件下五个样的上清和沉淀选取与编号
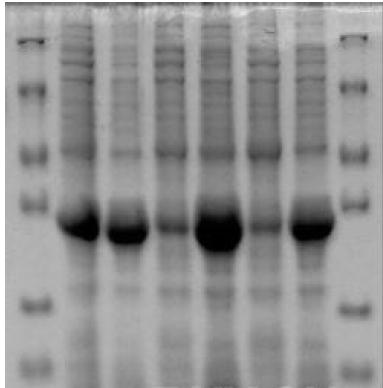
1: 231 上清,2: 231 沉淀,3: 232 上清,4: 232 沉淀,5: 233 上清,6: 233 沉淀,7: 234 上清,8: 234 沉淀,9: 235 上清,10: 235 沉淀
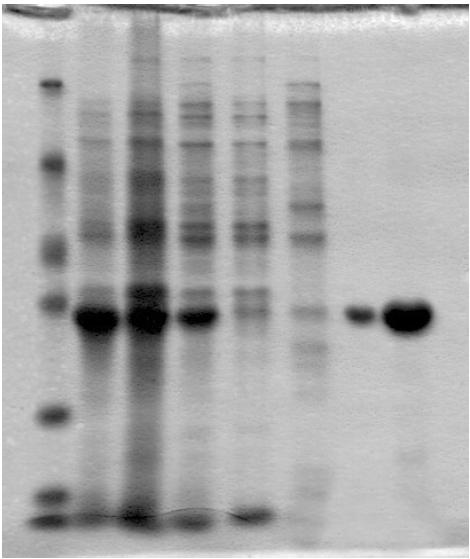
1: 234 上清,2: 234 沉淀,3: 303 上清,4: 303 沉淀,5: 373 上清,6: 373 沉淀
最终经过比对,确定23℃条件下,明显的提高了上清目的蛋白的含量,并且存在可溶表达平衡。20个小时后,蛋白表达将以包涵体的形式存在,即不论如何改变条件,可溶表达已经达到极限。所以无需探索更低温度等条件。

澳门威斯人游戏平台[亚洲]全站最新版V11.37.7 Nanjing Detai Bioengineering Co.,Ltd. ©2024 All Rights Reserved
苏ICP备2021019379号-1 | 网站地图 | 用户协议 | 隐私政策