![澳门威斯人游戏平台[亚洲]全站最新版V11.37.7](/wp-content/themes/2023/images/banner/technical-resources.jpg?v=18)
本文主要介绍了琼脂糖凝胶电泳的原理及实验操作步骤,及电泳后DNA的回收方法;琼脂糖凝胶的特点及电泳实验相关试剂的配置及琼脂糖凝胶电泳常见问题分析。
1、接1%含质粒的大肠杆菌细胞于2ml LB培养基
2、37℃振荡培养过夜
3、取100ul菌体于2mlEp管中,4000rpm离心3min,弃上清
4、加100ul溶液A(1%葡萄糖50mM/L EDTA pH8.0,25mM/L Tris-HCl pH8.0)充分混合
5、加入200ul溶液 B(0.2 mM/L NaOH,1% SDS),轻轻翻转混匀,置于冰浴5 min
6、加入150ul预冷溶液C(5 mol/L KAc,pH4.8),轻轻翻转混匀,置于冰浴5 min
7、10000rpm离心20min,取上清
8、加入等体积的异戊醇,混匀后于60℃静置10min
9、再次10000rpm离心20min,弃上清
10、用500ul70%的乙醇洗涤,抽干所有液体
11、待沉淀干燥,溶于5ul的TE缓冲液中(通常可获得3-5ug的DNA)
真核细胞DNA的提取是进行功能和结构研究的重要一步,真核DNA提取要保证DNA的完整性(不断裂)。真核DNA可以从培养的细胞新鲜的组织中提取。通常都是采用蛋白酶消化后用酚抽提获得。不同来源的材料进行不同的预处理,但是后续提取DNA的方法是类似的,提取的原则就是,尽量减少对DNA的破坏或降解,保持其完整性。具体提取步骤如下:
(一)材料预处理:
培养细胞用缓冲液洗涤后离心(4000rpm/5min)去除上清,得到细胞沉淀物加入10倍体积的裂解缓冲液,55℃水浴1-2小时;
组织(组织要剪碎匀浆)加入1.5ml到离心管中,加入20%的SDS 25ul,蛋白酶K(2mg/ml)25ul,然后混匀,60℃水浴1-3小时;
(二)DNA的提取(适用于处理后的细胞或组织)
提取DNA的物品需要高压灭菌,以防止带入其他核酸污染;试剂同样高压灭菌;
PCR扩增实验步骤详见:PCR标准操作流程。
琼脂糖凝胶电泳,是以琼脂糖为介质,对不同大小的DNA或RNA实现分离的一种电泳方法。琼脂糖是一种多糖,具有亲水性,但是不带电荷。使得DNA在碱性条件下使其带负电荷(pH8.0的缓冲液),在电流作用下,以琼脂糖凝胶为介质,由负极向正极移动,根据不同的DNA分子片段的大小和形状不同,在电场中泳动的速率也不相同,同时在样品中加入染料(如EB或花青素类染料)能够和DNA分子间形成络合物,经过紫外照射,可以看到DNA的位置(比对marker可知分子量大小),从而达到分离、鉴定的目的。如图1为琼脂糖凝胶电泳原理。
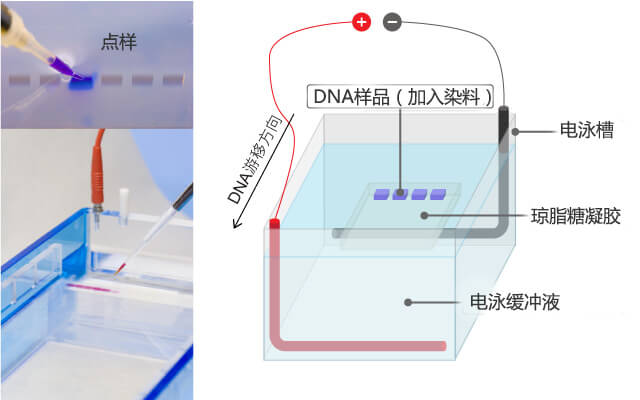
图1:琼脂糖凝胶电泳原理

图2:琼脂糖凝胶电泳仪器
琼脂糖凝胶配制浓度与DNA的最佳分离范围
| 琼脂糖浓度/% | 0.3 | 0.6 | 0.7 | 0.9 | 1.2 | 1.5 | 2.0 |
| DNA大小/kb | 5-60 | 1-20 | 0.8-10 | 0.5-7 | 0.4-6 | 0.2-4 | 0.1-3 |
(一)50 x TAE buffer(pH8.5)
在1L烧杯中准确称取Tris 242g,EDTA(Na)37.2g,加入800ml的去离子水,充分搅拌溶解,加入57.1ml的乙酸,充分搅拌,调pH8.5后,定容至1L。每次使用加水稀释50倍即1xTAE buffer。
(二)10 x TBE buffer(pH8.3)
在1L烧杯中准确称取Tris 108g,EDTA 7.44g,硼酸55g,加入800ml的去离子水,充分搅拌,调pH8.3后,定容至1L。
(三)6 x loading buffer
在500ml烧杯中,准确称取EDTA 4.4g,二甲苯青FF250mg、溴酚蓝(Bromophenol Blue)250mg,加入200ml去离子水,加热至充分溶解;在加入180ml甘油,条pH为7.0,用去离子水定容至500ml,常温保存。
对一些电泳结束的DNA进行回收,用于亚克隆或者探针标记。常用的方法有低熔点琼脂糖法,压碎法。或使用目前较为方便的试剂盒回收。下面介绍冻融法回收DNA片段。

澳门威斯人游戏平台[亚洲]全站最新版V11.37.7 Nanjing Detai Bioengineering Co.,Ltd. ©2024 All Rights Reserved
苏ICP备2021019379号-1 | 网站地图 | 用户协议 | 隐私政策